通用型CAR-T细胞产品CTD402获美国FDA儿科罕见疾病资格认定(RPDD)
2025年8月29日,中国生物医药行业再传捷报——北恒生物宣布其通用型CAR-T细胞产品CTD402获得美国FDA授予的儿科罕见疾病资格认定(RPDD),用于治疗复发/难治性T细胞急性淋巴细胞白血病和淋巴母细胞淋巴瘤。
这是继2025年3月该产品获得美国FDA批准新药临床试验(IND)后,北恒生物在国际化征程上实现的又一重要里程碑。标志着中国细胞治疗产业正在从"跟跑"向"并跑"甚至"领跑"转变。而在这背后,符合国际标准的GMP起始物料为项目的顺利推进提供了坚实基础。
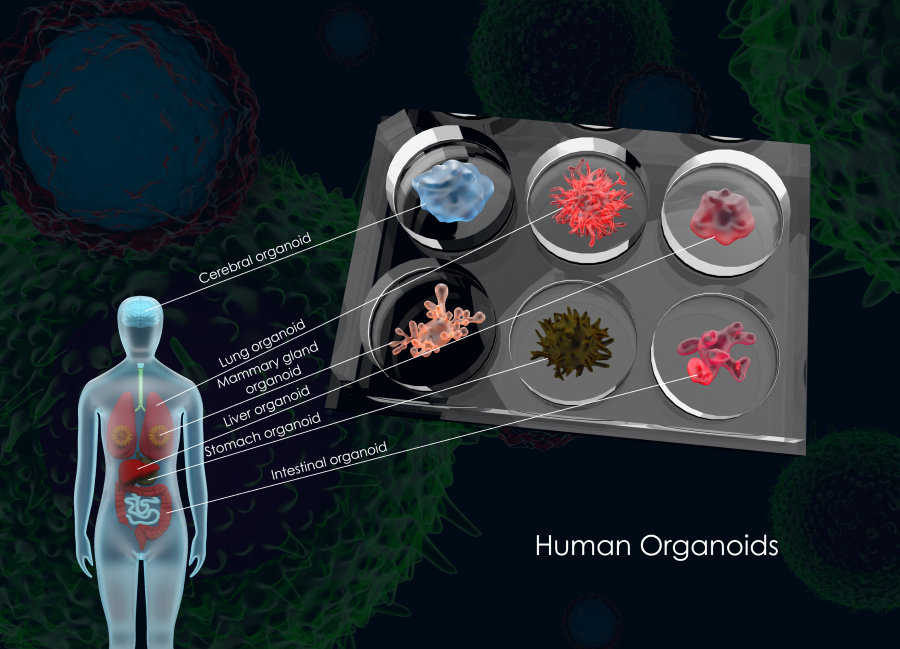
北恒生物CTD402是一款来源于健康供体的靶向CD7的通用型CAR-T细胞治疗产品。这类创新疗法的成功,高度依赖于高质量、符合全球监管标准的细胞起始物料。
作为细胞治疗产品的"源头",起始物料的质量直接决定了最终产品能否满足FDA、EMA等国际监管机构的严格要求。CTD402能够连续获得FDA IND批准和RPDD认定,证明了其生产工艺和物料控制已达到国际水准。
国际申报不仅是技术实力的比拼,更是质量体系和合规性文件的全面考核。FDA在审查IND申请时,对起始物料的关注点包括:完整的可追溯性,严格的质量控制,完备的法规文件。
Charles River提供的GMP合规细胞起始物料,配备全球监管机构公认的全套资质文件,正是帮助企业应对这些挑战的关键。
CTD402采用"单批次生产多人份使用"的即用型解决方案,这对起始物料的规模化和一致性提出了极高要求。
选择合规且可靠的GMP起始物料
Charles River Cell Sourcing 一如既往地注重高品质、合规性及面向客户的供应保障体系:
选择合规且可靠的起始物料供应商是全球化战略的第一步。Charles River的全套法规文件和支持为我们节省了大量审计和沟通成本,让团队能更专注于临床开发。
——北恒生物项目负责人
Charles River Cell Sourcing 拥有符合GMP的完整质量体系,提供细胞治疗领域所需的cGMP级别起始材料,致力于加速中国细胞治疗项目的商业化与全球化进程。
——Charles River 维通利华Cell Sourcing负责人
第一步:源头合规
从研发早期就选择符合国际GMP标准的起始物料,避免后续转换成本和技术风险。
第二步:全球视野
布局国际多中心临床研究,采用全球监管机构认可的质量体系和物料标准。
第三步:合作共赢
与具备国际经验和资质的供应商建立战略合作,借力其全球成功申报经验和监管知识。
第四步:长期规划
考虑商业化阶段的供应稳定性和成本控制,选择能够支撑从临床到商业化全阶段的合作伙伴。
选择国际认可的GMP起始物料,不仅是对质量的投入,更是为产品的全球化未来铺设道路。当中国创新遇上全球标准,我们将见证更多中国细胞治疗产品走向世界舞台。
如果您正在规划细胞治疗产品的全球化开发路径,我们的GMP合规细胞起始物料和专业团队将为您提供全方位支持。
产品咨询:CellTech@criver.cn
订购电话:010-84744520