动物健康监测是实验动物管理的重要环节。在选择监测方法时,对病原微生物的敏感性和特异性、人员可操作性和成本等都是考虑因素。脏垫料哨兵动物是目前种群健康监测中最常用的方法。而随着饲养设施逐渐从开放笼盒转换至微型隔离器,一些新兴的采样耗材搭配传统方法的组合可以更好地覆盖无法通过脏垫料传播的病原微生物排查。


在对实验动物进行健康监测时,直接抽选种群中的动物检测是最直接有效的方式。比如使用开放式笼具饲养的场景中,可以通过群体抽样来进行健康监测。随着生物安全防护级别的升级,比如IVC和微型隔离器的使用,病原微生物流行率大大降低,随之需要抽检更高比例的种群动物才能及时发现感染情况。
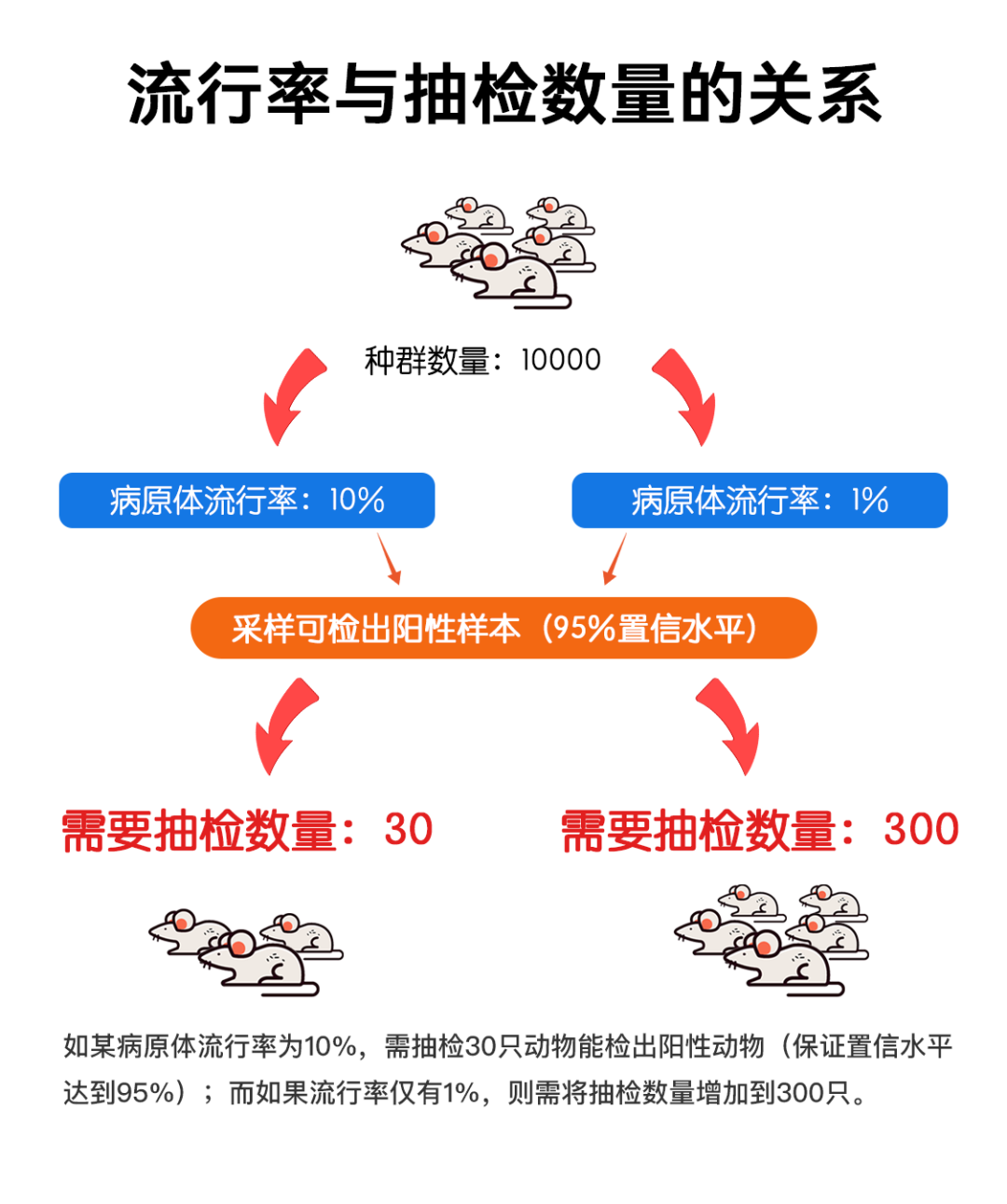
同时这也会带来动物的大量浪费。因此,针对低流行率病原体,直接检测种群动物的方法并不可行,如今,大部分设施选择哨兵动物。脏垫料哨兵动物是目前监测IVC饲养动物或免疫缺陷动物的标准方法。尤其是对于免疫缺陷动物,本身不能正常产生抗体,可以使用免疫功能正常的哨兵动物作为替代检测。
尽管使用脏垫料哨兵动物监测动物群体健康状况的方式已广泛应用,管理者也应留意一些可能带来风险的潜在因素:

为了解决哨兵动物监测方法的局限性,PCR方法孕育而生,无哨兵动物健康监测方案可优化啮齿动物病原体的检测,减少或替代哨兵动物的使用,支持3R原则。

已有大量数据表明,相较于传统的脏垫料哨兵动物法,基于PCR的啮齿动物检疫和常规健康监测采样方案可以更好地提升病原体的检出率。从IVC排气室下游收集排气粉尘(EAD®),并与特定位置的环境拭子合样,可以有效地监测笼架上的所有笼盒。Tecniplast和Allentown两家公司更是创建了微生物捕捉器(In-line Collection Media),简化了EAD收集过程。然而EAD® PCR检测只适用于IVC笼架,不适用于IVC笼盒和静态微隔离器笼盒。虽然也有检测脏垫料哨兵笼盒过滤器的方法,但方法比较繁琐,应用范围有限。
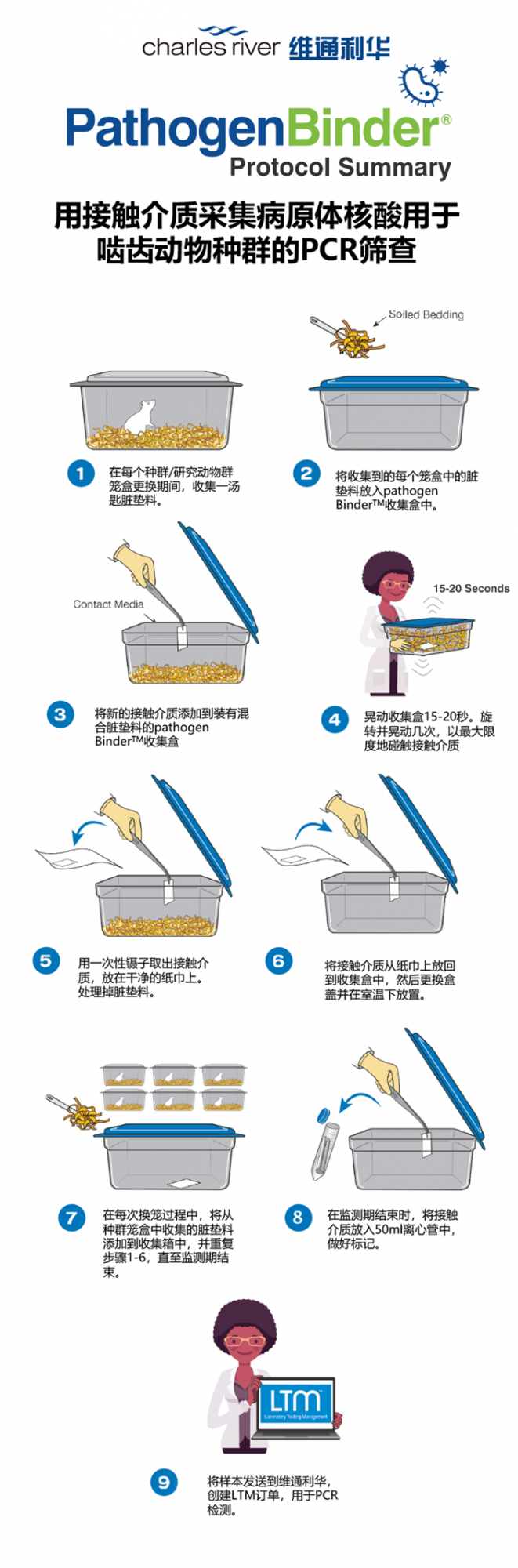
使用接触介质(或收集介质,通常是用过滤材料或拭子),直接从混合脏垫料中吸附与传染源相关的灰尘颗粒,通过PCR法检测病原体,是另一种先进的病原微生物检测方法。
Charles River Laboratories(CRL)进一步对接触介质的材料进行了筛选和标准化,即:PathogenBinder®
结合CRL专有的PCR检测技术,优化了啮齿动物病原体检测方法,降低了样本采集过程以及检测实验室对样本处理中的不确定风险。研究表明:在适宜条件下,PathogenBinder®检测到的病原体数量是脏垫料哨兵鼠所能检测到 3 倍。

图1:接触介质:Charles River Laboratories研究评估了6种代表不同材料和颗粒结合特性的接触介质,并选出最佳接触材质。

图2:收集箱,用于接触介质和脏垫料的充分接触与吸附。

PathogenBinder ®的研究使用宠物鼠作为病原体传染源,接触介质监测到的病原体数量及阳性个体数均显著高于脏垫料哨兵。
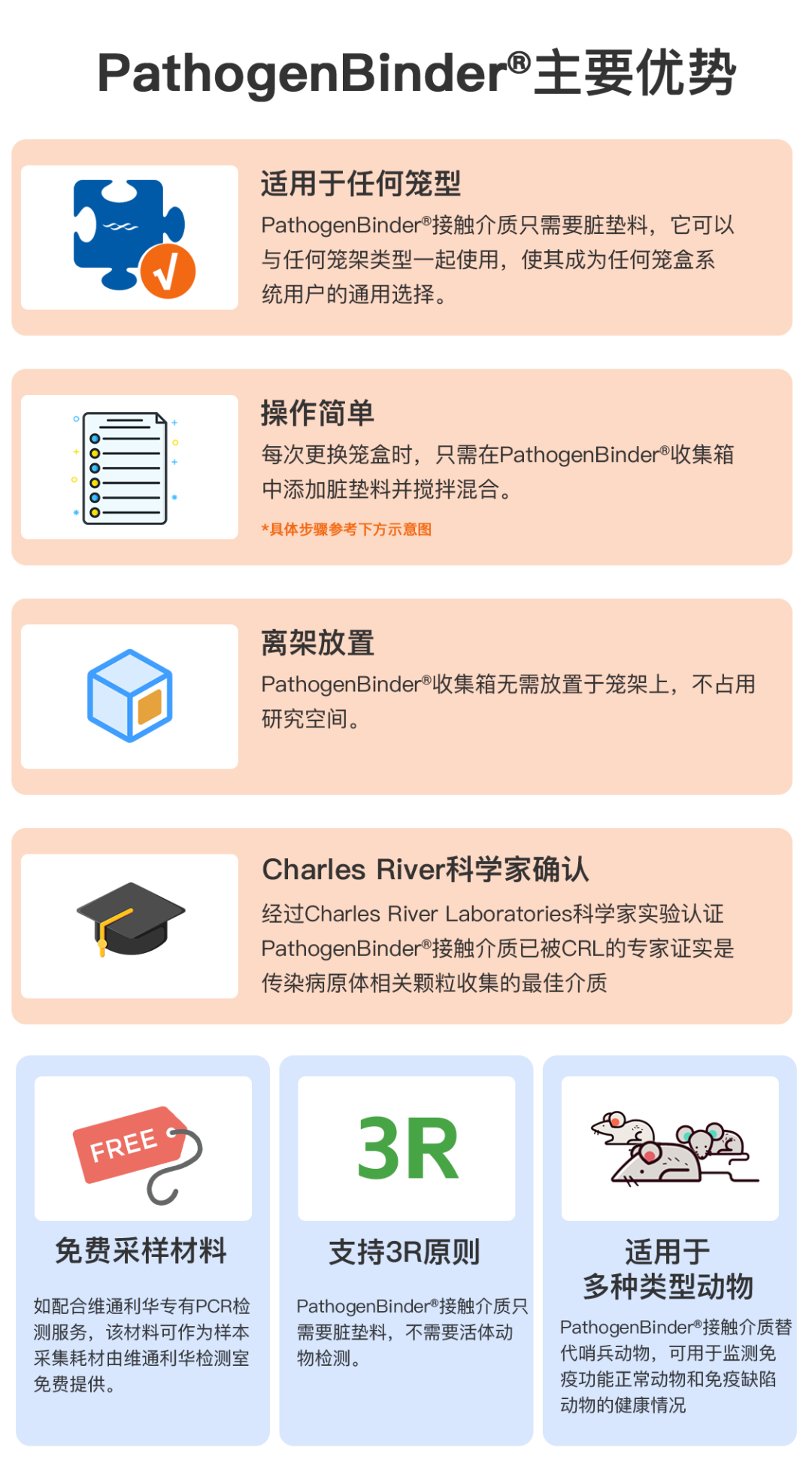
此外,PathogenBinder®检测还具有以下优势特点:
截止2023年5月,海外已有220多家机构尝试或正式开始使用PathogenBinder®。
Companion Guide to Rodent Health Surveillance for Research Facilities.
A Guide to Modern Strategies for Infection Surveillance of Rodent Populations: Beyond Sentinels.
Microbiological monitoring in individually ventilated cage systems.
Sentinel-free Detection of Rodent Infectious Agents by Contact Media Agitation in Soiled Bedding.
PCR-based Pathogen Screening of Lab Rodent Vivaria Works.
PathogenBinder™: A Refined and Standardized Soiled-Bedding Sampling Method for the Detection of Rodent Infectious Agents.