代谢综合征的发病率在全球范围内持续攀升,尤其在青少年和中年人群中更为显著。代谢综合征是指一系列代谢异常的集合,可能引发心血管疾病、2型糖尿病、中风、肾脏损伤等严重健康问题,极大增加患者早逝和残疾的风险。
本文推出一款新型动物模型——ZDSD大鼠(Zucker Diabetic Sprague Dawley Rats),它能够更精确地模拟人类代谢综合征的疾病发展过程,包括糖尿病前期的代谢综合征、糖尿病及其并发症,是一种极具潜力的临床前代谢性疾病研究模型。与传统的2型糖尿病和肥胖模型相比,ZDSD大鼠具有以下优势:
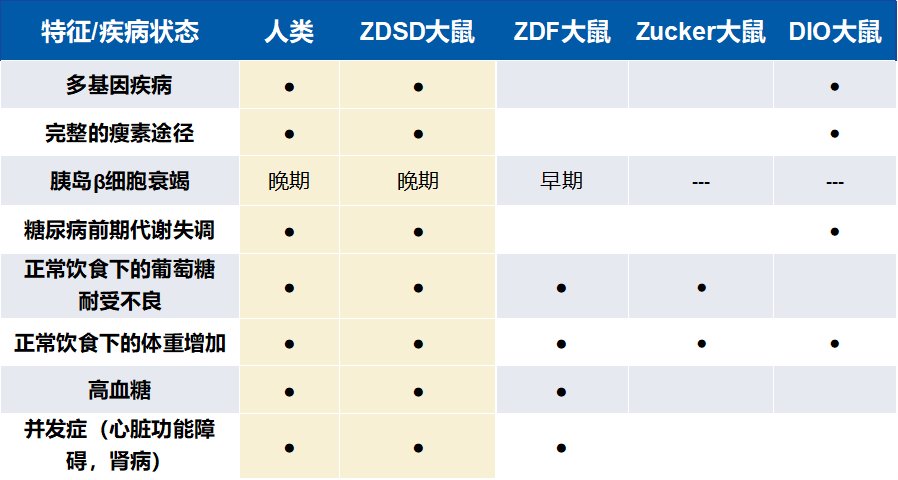
注:“●”表示该模型具有或模拟了相应的人类特征或疾病状态;“空白”表示该模型不具备或不模拟该特征或疾病状态;“---”表示无数据。
从上表可以看出,ZDSD大鼠与人类代谢疾病进展方面具有高度相似性,是一种临床转化度更高的实验动物。那么,这种模型是如何培育出来的呢?
传统的2型糖尿病模型,如db/db、ob/ob和ZDF大鼠等,虽然呈现糖尿病表型,但由于其瘦素受体通路存在缺陷,导致疾病快速进展至糖尿病阶段,胰岛β细胞迅速衰竭。这些模型的疾病发展时间与人类代谢疾病及糖尿病的自然进程存在较大差异。瘦素通路完整的CD(SD)高脂饮食诱导肥胖(DIO)大鼠,虽然动物出现肥胖体征,但往往缺乏其它相关的代谢疾病症状,如高甘油三酯血症、高血糖及糖尿病相关的并发症等。

为培育与人类代谢疾病进展更相近的模型,Richard Peterson将具有β-细胞基因转录缺陷的瘦型ZDF大鼠 (Lean +/+)与肥胖的Crl:CD(SD)(DIO-SD)模型特性结合,最终培育出一种保留关键瘦素途径的肥胖糖尿病模型。
在十几年的模型开发过程中,通过对β细胞缺陷的ZDF大鼠与DIO-SD大鼠的杂交后代进行多代筛选,不断选育表现出肥胖且具有糖尿病倾向的动物,并选择性近交35代以上,培育出ZDSD大鼠。
下图展示了ZDSD不同周龄血清瘦素水平表达和瘦素敏感性,证明ZDSD瘦素通路完整,不依赖于单基因瘦素或瘦素受体突变来发展肥胖症和2型糖尿病。
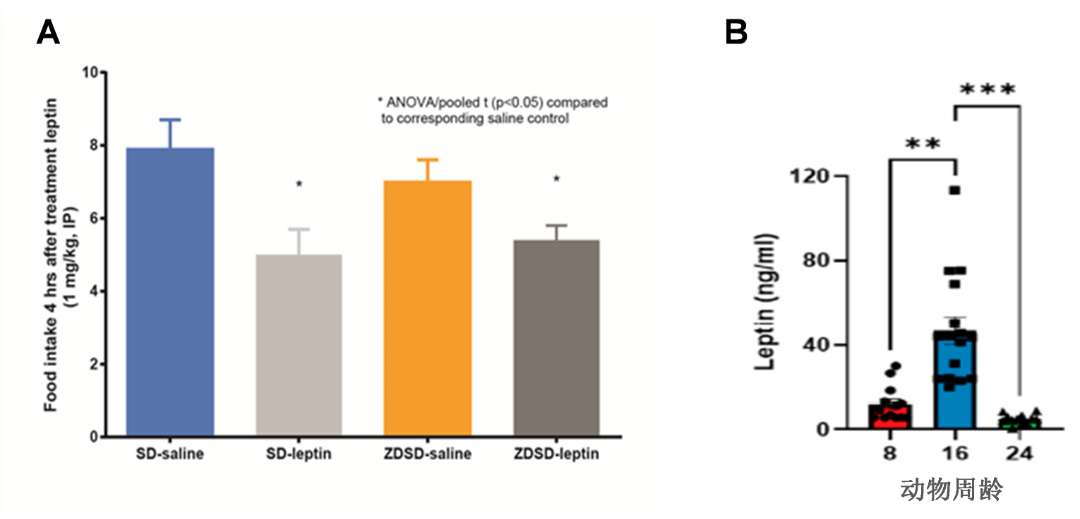
图1. 血清Leptin水平及敏感性测试
A:给与1 mg/kg leptine 后,ZDSD大鼠4小时内采食量的变化;
B:不同周龄ZDSD大鼠血Leptine水平的变化(Weninger, S.N. (2023) Metabolites)。
下面两个图分别是人类2型糖尿病的自然发病进程史和ZDSD大鼠血糖的进展情况。图中的垂直虚线为糖尿病与糖尿病前期的分界线,从糖尿病的发生发展来看,ZDSD与人类及其相似,糖尿病的发生发展包括糖尿病前期(8-16周),再到明显的糖尿病阶段(>16周),以及后期出现的明显的胰岛素分泌不足引起的并发症(24+周)等,是一款可以提供预防兼具治疗糖尿病的新型动物模型。此外,已有研究对ZDSD大鼠糖尿病进展各阶段进行了肠道微生物群相关的报道(Weninger, S.N. (2023) Metabolites)。
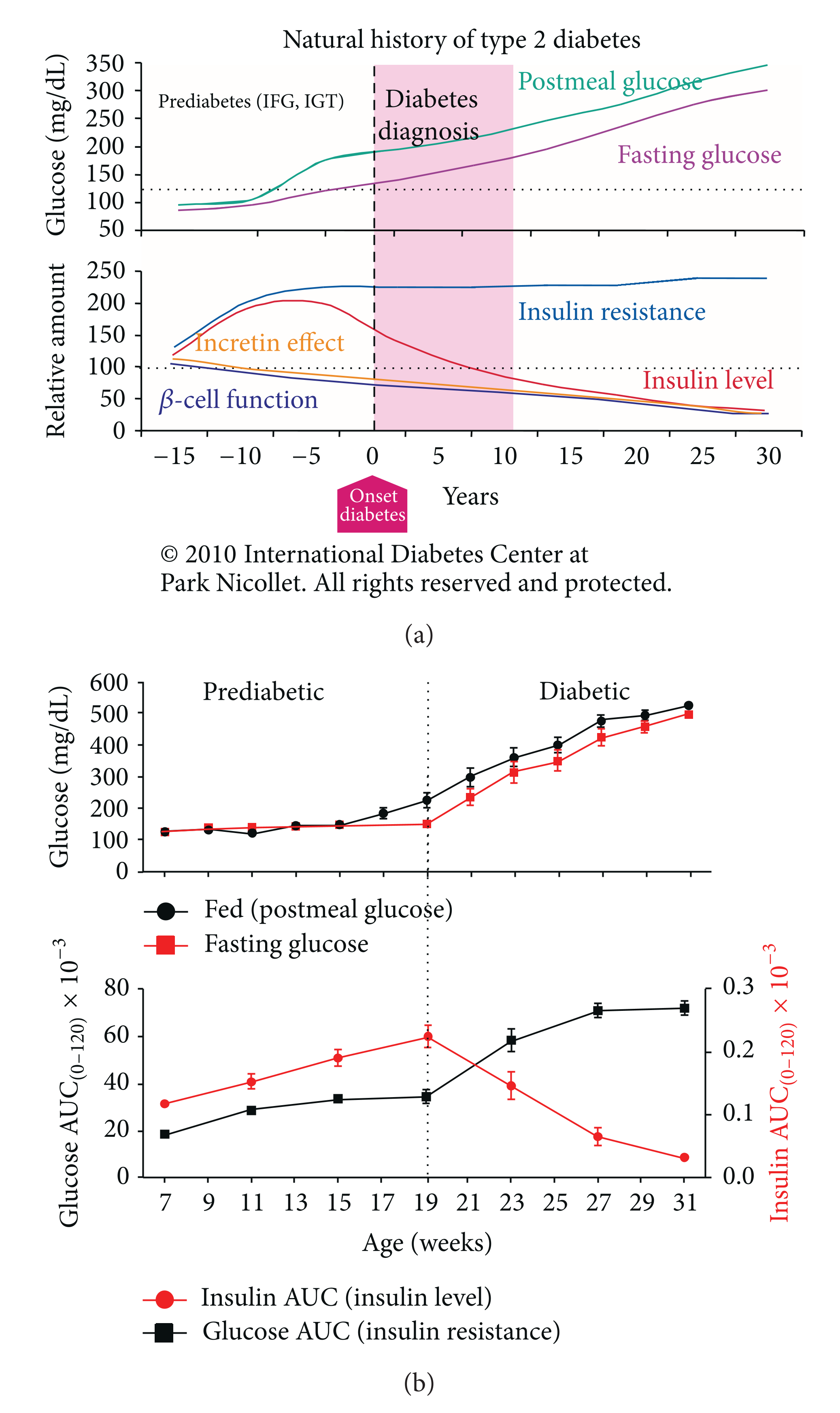
图2
(a)来源于《2型糖尿病的自然史》(2010年),由美国明尼苏达州明尼阿波利斯的国际糖尿病中心提供; 上半部分图表显示了随着时间推移,空腹和餐后血糖水平的升高。下半部分图表则展示了胰岛素抵抗和β细胞功能障碍的情况;
(b)展示了ZDSD大鼠血糖及AUC随年龄的变化情况。

体重增加,体脂率升高,血脂水平升高,血压升高。
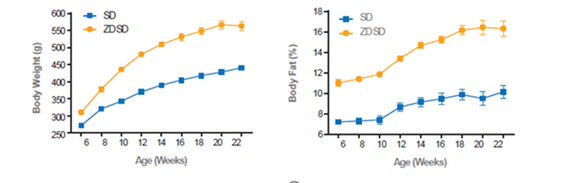
图3.ZDSD体重和体脂变化
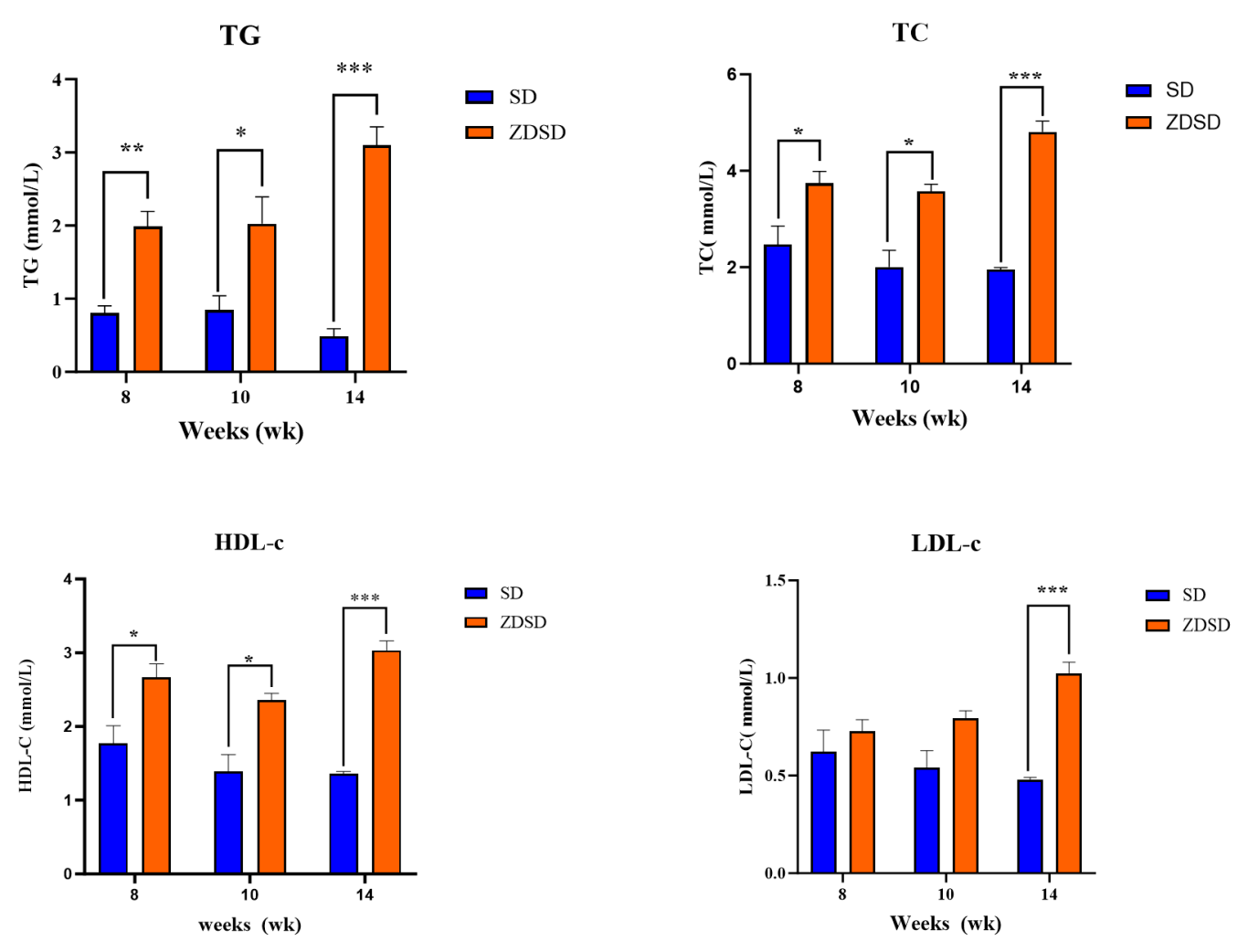
图4.ZDSD血脂水平
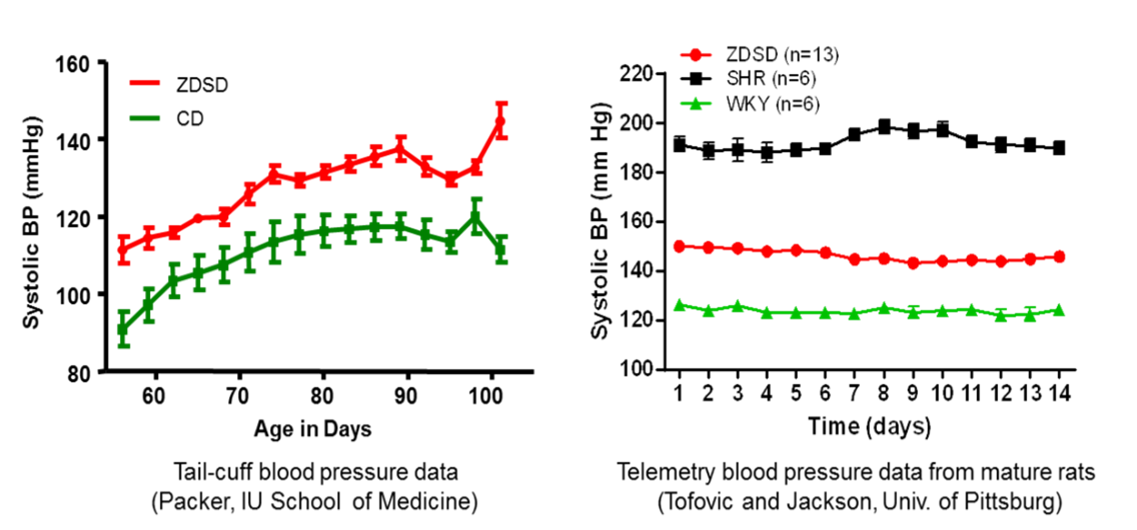
图5.ZDSD大鼠血压变化
ZDSD大鼠自发性高血糖进展缓慢。可诱导通过高脂饮食快速诱导进入高血糖(RD12468)。胰岛素水平随着糖尿病进展下降。
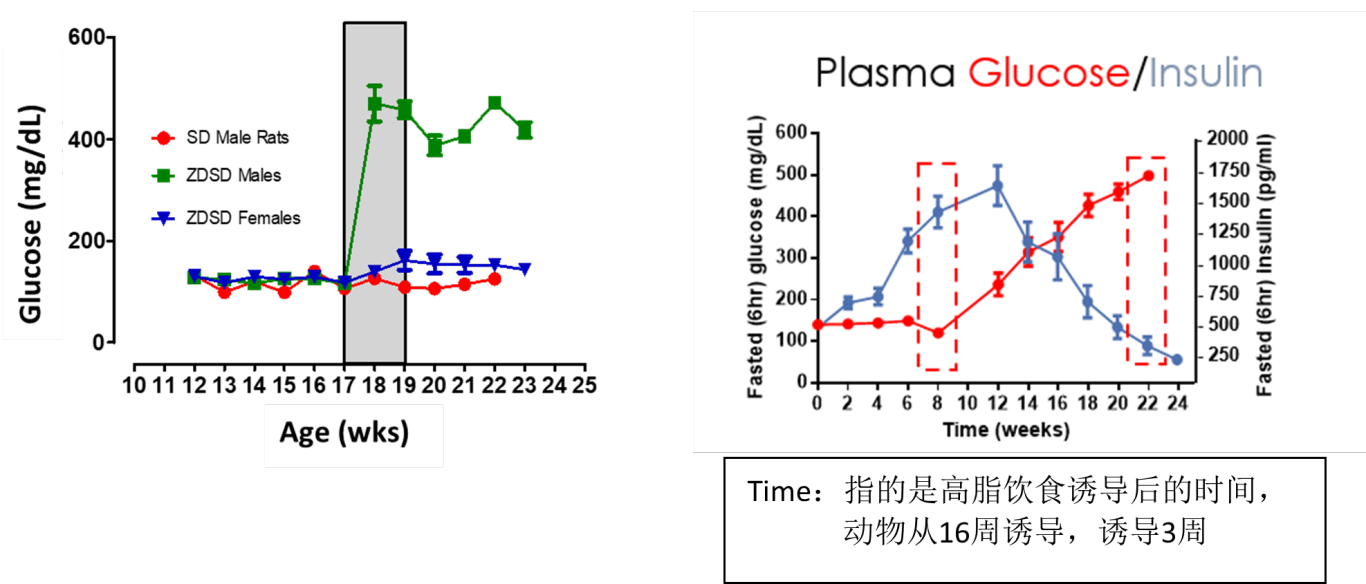
图6.ZDSD大鼠糖尿病发展进程
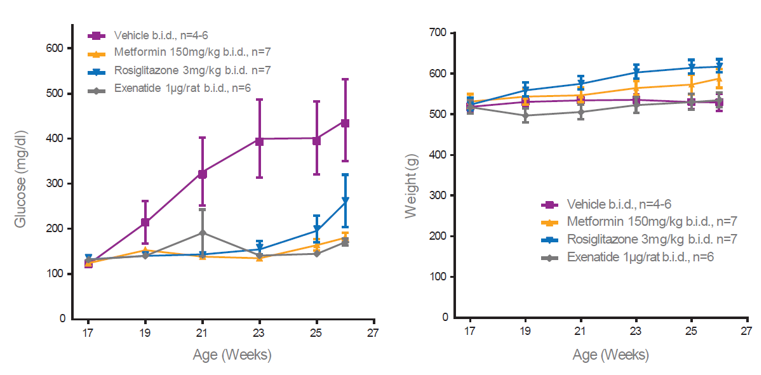
图7.ZDSD大鼠对多种抗糖药物均有治疗反应
包括肾病、神经病变、心血管疾病、伤口愈合延迟、脂肪肝等症状的产生。
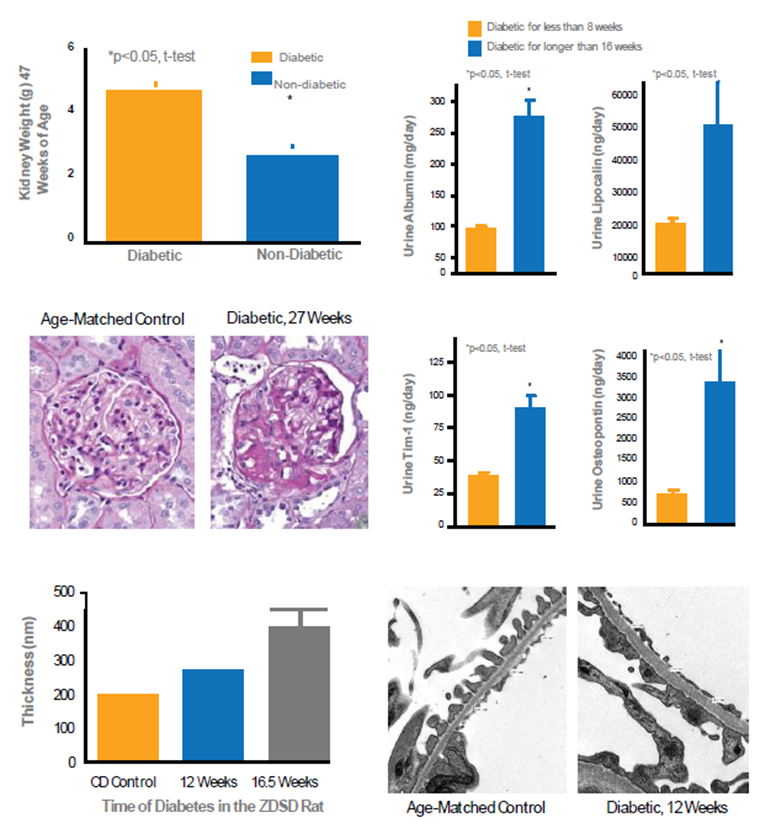
图8.ZDSD大鼠相关的糖肾数据
更多模型及药效验证信息,请联系维通利华产品经理:Product@criver.cn
订购:Order@criver.cn
1.多基因肥胖模型:ZDSD大鼠是一种多基因肥胖模型,它没有瘦素或瘦素受体的突变。
2.培育过程:通过将ZDF大鼠(Lean+/+,即瘦型)与CD(SD) DIO大鼠杂交,然后选择性繁殖以选择肥胖和糖尿病特征,培育出ZDSD大鼠。ZDSD大鼠已经进行了35代以上的近亲繁殖,以稳定其遗传特性。
3.前期代谢综合征:包括胰岛素抵抗、血脂异常和高血压。
4.2型糖尿病进展:ZDSD大鼠的2型糖尿病进展与人类疾病相似,包括糖尿病前期(8-16周)、明显的糖尿病(超过16周)以及糖尿病并发症(24周以上)。
5.糖尿病并发症:包括肾病、神经病变、脂肪肝等。
6.研究应用:ZDSD大鼠模型可以用于研究肥胖、代谢综合征、糖尿病及其并发症,为这些疾病的临床治疗提供信心。
1.Han L, Bittner S, Dong D, Cortez Y, Bittner A, Chan J, Umar M, Shen WJ, Peterson RG, Kraemer FB, Azhar S. Molecular changes in hepatic metabolism in ZDSD rats-A new polygenic rodent model of obesity, metabolic syndrome, and diabetes. Biochim Biophys Acta Mol Basis Dis. 2020 May 1;1866(5):165688.
2.Sun G, Zhang G, Jackson CV, Wang Y-X. Zucker Diabetic Sprague Dawley (ZDSD) Rat, A Spontaneously Diabetic Rat Model Develops Cardiac Dysfunction and Compromised Cardiac Reserve. Cardiology Research and Cardiovascular Medicine 2018; CRCM-133.
3.Bhamb N, Kanim LEA, Maldonado RC, Nelson TJ, Salehi K, Glaeser JD, Metzger MF. The impact of type 2 diabetes on bone metabolism and growth after spinal fusion. Spine J. 2019 Jun;19(6):1085-1093.
4.Peterson RG, Jackson CV, Zimmerman KM. The ZDSD rat: a novel model of diabetic nephropathy. Am J Transl Res. 2017 Sep 15;9(9):4236-4249.
5.Suckow MA, Gobbett TA, Peterson RG. Wound Healing Delay in the ZDSD Rat. In Vivo. 2017 Jan 2;31(1):55-60.
6.Choy S, de Winter W, Karlsson MO, Kjellsson MC. Modeling the Disease Progression from Healthy to Overt Diabetes in ZDSD Rats. AAPS J. 2016 May 31.
7.Creecy A, Uppuganti S, Merkel AR, O'Neal D, Makowski AJ, Granke M, Voziyan P, Nyman JS. Changes in the Fracture Resistance of Bone with the Progression of Type 2 Diabetes in the ZDSD Rat. Calcif Tissue Int. 2016 Sep;99(3):289-301.
8.Peterson RG, Jackson CV, Zimmerman K, de Winter W, Huebert N, Hansen MK. Characterization of the ZDSD Rat: A Translational Model for the Study of Metabolic Syndrome and Type 2 Diabetes. J Diabetes Res. 2015;2015:487816.
9.Jackson EK, Mi Z, Tofovic SP, Gillespie DG. Effect of dipeptidyl peptidase 4 inhibition on arterial blood pressure is context dependent. Hypertension. 2015 Jan;65(1):238-49
10.Davidson EP, Coppey LJ, Holmes A, Lupachyk S, Dake BL, Oltman CL, Peterson RG, Yorek MA. Characterization of diabetic neuropathy in the Zucker diabetic Sprague-Dawley rat: a new animal model for type 2 diabetes. J Diabetes Res. 2014;2014:714273.
11.Hill Gallant KM, Gallant MA, Brown DM, Sato AY, Williams JN, Burr DB. Raloxifene prevents skeletal fragility in adult female Zucker Diabetic Sprague-Dawley rats. PLoS One. 2014 Sep 22;9(9):e108262.
12.Fajardo RJ, Karim L, Cailey VI, Bouxsein ML. A review of rodent models of type 2 diabetic skeletal fragility. J Bone Miner Res. 2014;29(5):1025-40.
13.Quadri SS, Stratford RE, Boué SM, Cole RB. Identification of glyccollin metabolites derived from conjugation with glutathione and glucuronic acid in male ZDSD rats by online liquid chromatography-electrospray ionization tandem mass spectrometry. J Agric Food Chem. 2014 Mar 26;62(12):2692-700.
14.Davis JE, Cain J, Banz WJ, Peterson RG. Age-Related Differences in Response to High-Fat Feeding on Adipose Tissue and Metabolic Profile in ZDSD Rats. ISRN Obes. 2013 May 20;2013:584547.
15.Gonzalez AD, Gallant MA, Burr DB, Wallace JM. Multiscale analysis of morphology and mechanics in tail tendon from the ZDSD rat model of type 2 diabetes. J Biomech. 2014 Feb 7;47(3):681-6.
16.Hammond MA, Gallant MA, Burr DB, Wallace JM. Nanoscale changes in collagen are reflected in physical and mechanical properties of bone at the microscale in diabetic rats. Bone. 2014 Mar;60:26-32.
17.Reinwald S, Peterson RG, Allen MR, Burr DB. Skeletal changes associated with the onset of type 2 diabetes in the ZDF and ZDSD rodent models. Am J Physiol Endocrinol Metab. 2009 Apr;296(4):E765-74. doi: 10.1152/ajpendo.90937.2008. Epub 2009 Jan 21. PMID: 19158319 Free PMC Article.
18. Weninger SN, Ding A, Browne EN, Frost ML, Schiro G, Laubitz D, Duca FA. Longitudinal Characterization of the Gut Microbiota in the Diabetic ZDSD Rat Model and Therapeutic Potential of Oligofructose. Metabolites. 2023 May 16;13(5):660. doi: 10.3390/metabo13050660. PMID: 37233701; PMCID: PMC10220957.