近年来,CAR-T细胞疗法在血液瘤、部分实体瘤和自身免疫疾病中展现了强大的治疗效果。然而,传统的体外制备CAR-T细胞过程复杂、成本高昂且制备周期长,还可能引发严重毒副作用(如CRS和ICANS)等问题,限制了其广泛应用。体内CAR-T细胞疗法(in vivo CAR-T)被誉为下一代细胞治疗的“明珠”,其核心优势在于无需复杂的体外制备,直接将CAR基因通过病毒或非病毒载体(如脂质纳米颗粒等)将CAR基因直接递送到体内的T细胞中,使其表达嵌合抗原受体。这种方法避免了复杂且昂贵的体外细胞制备过程,大大降低了治疗成本和时间,同时将扩展到更多疾病研究领域,使CAR-T疗法有望变得更加普惠。
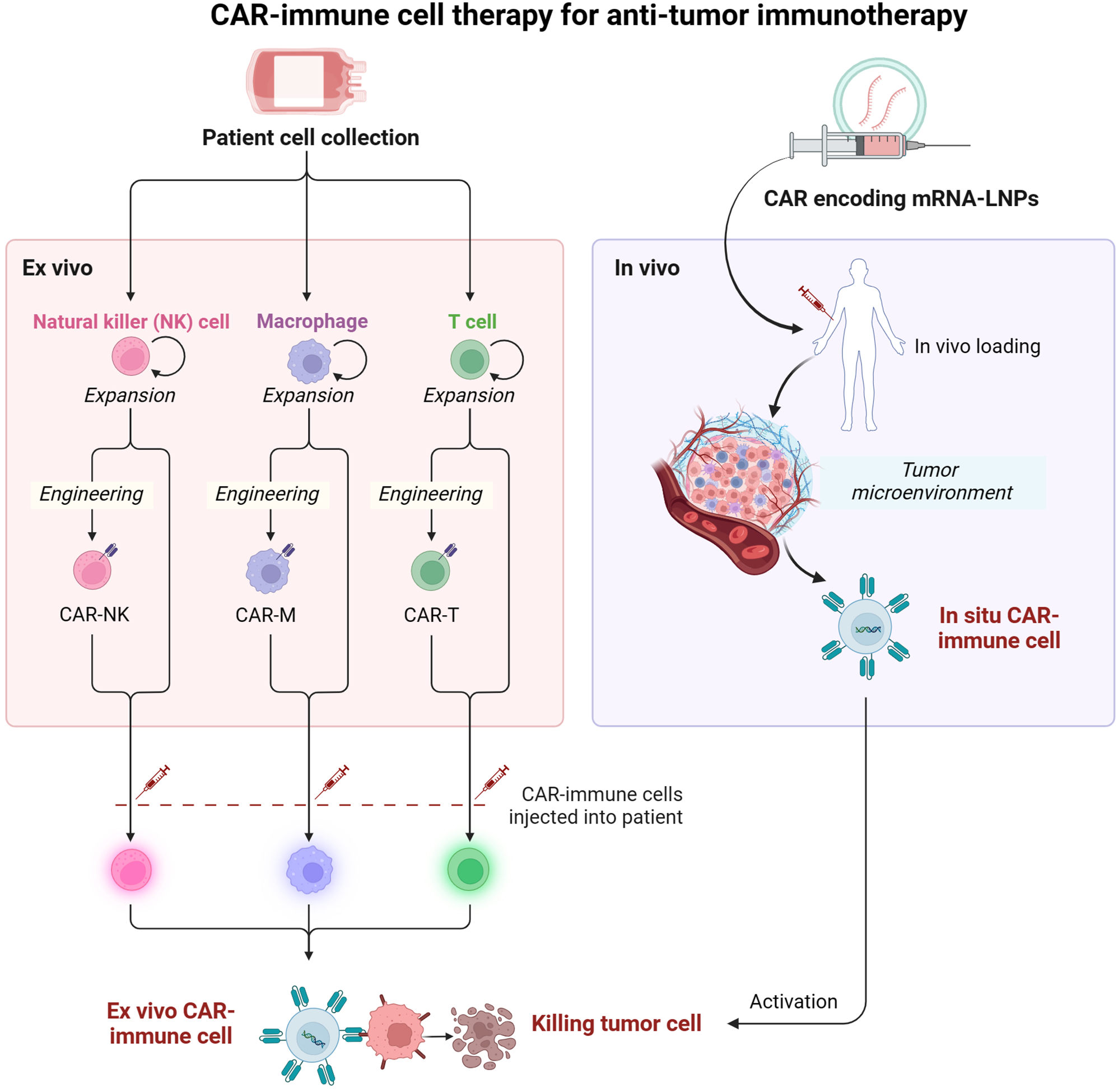
体外和体内CAR免疫细胞治疗[1]
在in vivo CAR-T技术走向临床的过程中,动物模型成为了验证治疗安全性与有效性的关键平台。由于人鼠免疫生物学的差异性,传统动物模型无法完全模拟人体内复杂的免疫微环境,导致研究结果与临床实际存在显著差距。
免疫系统人源化(HIS)模型通过将人源造血干细胞(HSC)或外周血单个核细胞(PBMC)移植到重度免疫缺陷的NOG系列小鼠体内,重建出功能性的人类免疫系统,为评估in vivo CAR-T效果提供了理想平台,可以更精准地预测临床效果,加速技术转化。
机制
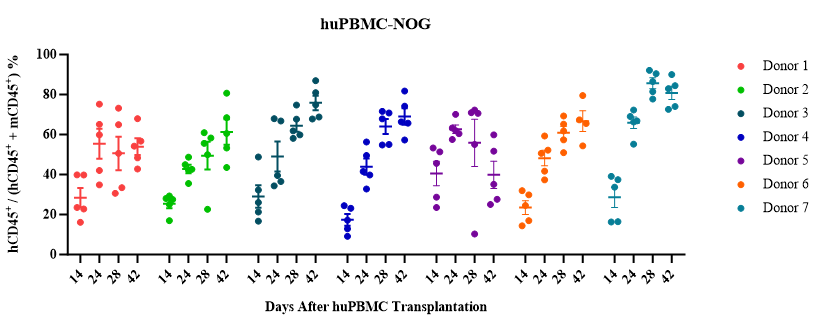
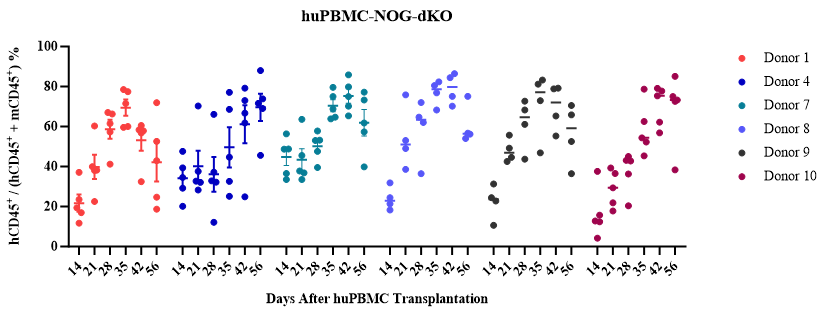
huPBMC直接静脉注射到重度免疫缺陷小鼠NOG或NOG-dKO体内重建人源T/B细胞。
特性
1) 造模周期短,成本低,T细胞快速重建且功能活跃;
2) huPBMC-NOG模型会发生GvHD反应,实验窗口期短(4-6周),无法用于长期研究;
3) huPBMC-NOG-dKO模型GvHD大大减缓,减少非特异性T细胞扩增的干扰,实验窗口期长(8-12周);
4) 重建的免疫细胞谱系相对单一:外周血主要重建T细胞,免疫器官重建T/B细胞。
in vivo CAR-T研究的适用场景:
早期发现与筛选
1) 转导有效性验证:快速筛选多种CAR结构、注射不同病毒或非病毒载体后能否成功感染人源T细胞并在体内产生功能性CAR-T细胞;
2) 抗肿瘤药效评估:监测肿瘤体积变化,评估in vivo生成的CAR-T细胞能否清除构建好的人源肿瘤;
3) 自免疾病疗效评估:通过监测B细胞的清除效果,评估in vivo生成的CAR-T细胞对B细胞介导的自身免疫性疾病的治疗效果;
4) 初步安全性评估:观察是否出现急性毒性反应,如细胞因子释放综合征(CRS)。
机制
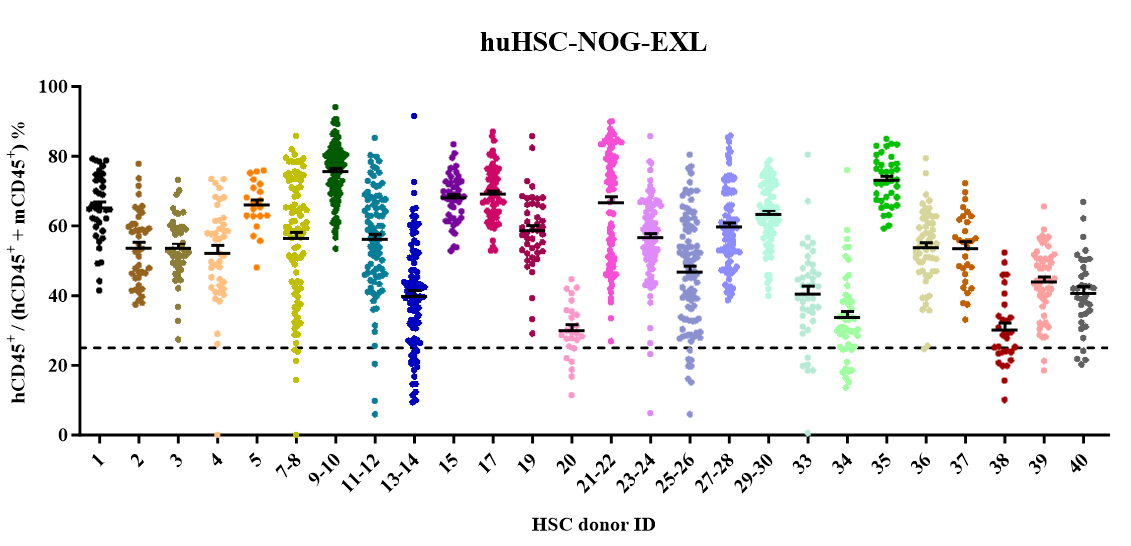
NOG-EXL小鼠辐照后静脉注射CD34+ HSC,重建多谱系、长期稳定的人源免疫系统。
特性
1) 现货供应,即订即用,有效缩短准备时间;支持长周期造模,适用于更广泛的研究领域;
2) 多种免疫细胞重建:人源T、B及髓系细胞,更模拟人源免疫细胞组成,为in vivo CAR-T功能研究提供最接近临床的微环境;
3) 重建具有供体差异性。
in vivo CAR-T研究的适用场景:
临床前综合评估有效性和安全性
1) 转导有效性验证:注射的载体能否成功感染人源T细胞并在体内产生功能性CAR-T细胞;
2) 评估抗肿瘤疗效和持久性: 在更贴近临床的免疫微环境中研究in vivo CAR-T的功能、耗竭和记忆形成;
3) 自免疾病疗效评估:通过监测B细胞的清除效果,评估in vivo生成的CAR-T细胞对B细胞介导的自身免疫性疾病的治疗效果;
4) 全面预测安全性:
In vivo CAR-T细胞疗法在肿瘤[2]、自身免疫疾病[3]、纤维化疾病[4]及衰老[5]的治疗领域有了初步的探索和应用,其研究正处在一个极其活跃的爆发期。
基于重度免疫缺陷NOG系列模型小鼠构建的HIS模型是推动in vivo CAR-T疗法从概念走向临床的不可或缺的工具:huPBMC重建模型是早期发现与筛选的“先锋”,huHSC重建模型是临床前综合评估的“法庭”,用于最终审判疗效及安全性。两者结合,为新兴in vivo CAR-T细胞疗法提供坚实可靠的临床前数据包,加速研发,最大限度地降低临床开发风险,最终造福患者。
NOG系列小鼠,该系列模型遗传稳定、高健康标准、国内外认可度高。
NOG
hIL-2 NOG
NOG-dKO
hIL-15 NOG
NOG-EXL
NOGF
NOG-W41
NOGF-hIL15
huPBMC重建模型:PBMC供体经过预筛选和重建验证,可锁定供体,持续供应;
huHSC-NOG-EXL模型:每只小鼠均进行免疫重建验证,可提供HSC移植后7周末的流式验证数据,保证hCD45+(%)>25%。
如果您正在从事CAR-T或其它肿瘤免疫疗法的研发,希望了解更多关于免疫系统人源化模型的技术细节和案例数据,欢迎联系我们!
关注我们,
获取更多前沿动物模型信息!
产品咨询:Product@criver.cn
订购电话:010-84744555
订购邮箱:Order@criver.cn
临床前模拟人类免疫系统:huHSC模型的多面应用及选择(附内测数据+研发案例)
[1] Zhang, W., Huang, X. In vivo gene editing and in situ generation of chimeric antigen receptor cells for next-generation cancer immunotherapy. J Hematol Oncol 17, 110 (2024). https://doi.org/10.1186/s13045-024-01633-7
[2] Xu, Jia et al. In-vivo B-cell maturation antigen CAR T-cell therapy for relapsed or refractory multiple myeloma. The Lancet, Volume 406, Issue 10500(2025). https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(25)01030-X/fulltext
[3] Wang Q, Xiao Z, Zheng X, et al. In vivo CD19-CAR T-Cell Therapy for Refractory Systemic Lupus Erythematosus. N Engl J Med 2025, DOI: 10.1056/NEJMc2509522
[4] Yan, J., Wang, SY., Su, Q. et al. Targeted immunotherapy rescues pulmonary fibrosis by reducing activated fibroblasts and regulating alveolar cell profile. Nat Commun 16, 3748 (2025). https://doi.org/10.1038/s41467-025-59093-7
[5] Zhang, Zihan et al. Cardiolipin-mimic lipid nanoparticles without antibody modification delivered senolytic in vivo CAR-T therapy for inflamm-aging. Cell Reports Medicine, Volume 6, Issue 7, 102209(2025). https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(25)00282-4