无论是传统的小分子抗肿瘤药物,还是目前火热的肿瘤免疫疗法,肿瘤的类别、小鼠的免疫缺陷程度、临床前的动物模型是否需要人源化,都是早期研究阶段需要重点考虑的问题。本文将就这几个方面的考量因素做一个简短的阐述,为项目初期的决策提供参考。
关于肿瘤模型的选择,接到客户的咨询或委托项目时,我们一般自问4个问题,做到心中有数,尽可能减少因实验条件选择差异而造成的不确定性。
——有一定的“模糊对应关系”。一般来说,最常用的裸鼠、SCID鼠即可满足大多数肿瘤细胞系的荷瘤鼠造模,在借助经验或参考文献的基础上即可判断特定肿瘤类别所适用的免疫缺陷鼠。但对于淋巴瘤、转移瘤等,在常规免疫缺陷鼠上通常难以造模成功,在(超)重度免疫缺陷模型(如NOG)上成瘤表现更好。例如Dewan MZ et al. 在将Hodgkin淋巴瘤转移至NOG小鼠的实验中发现,在未对动物进行全身辐照或自然免疫阻断预处理的条件下,移植30-60天内肿瘤的形态和CD30 标志物表达都能保持和原始肿瘤接近。Ninomiya M et al. 在胰腺癌细胞系的转移评估实验中,发现对比NOD SCID小鼠,在NOG小鼠身上能观察到更多的肿瘤转移现象。
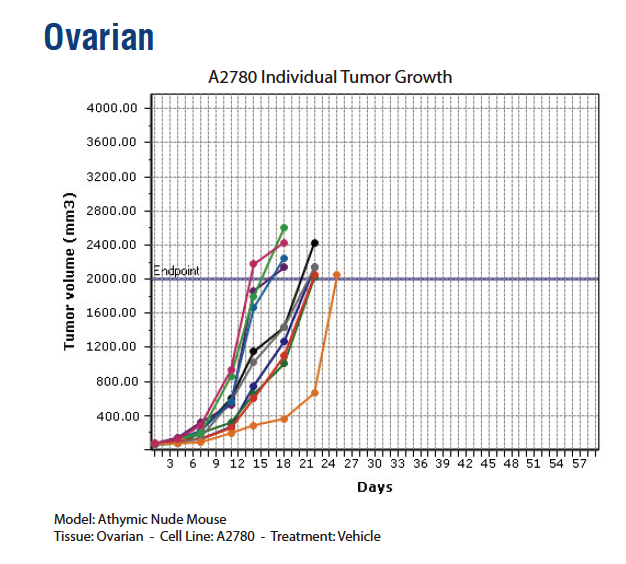
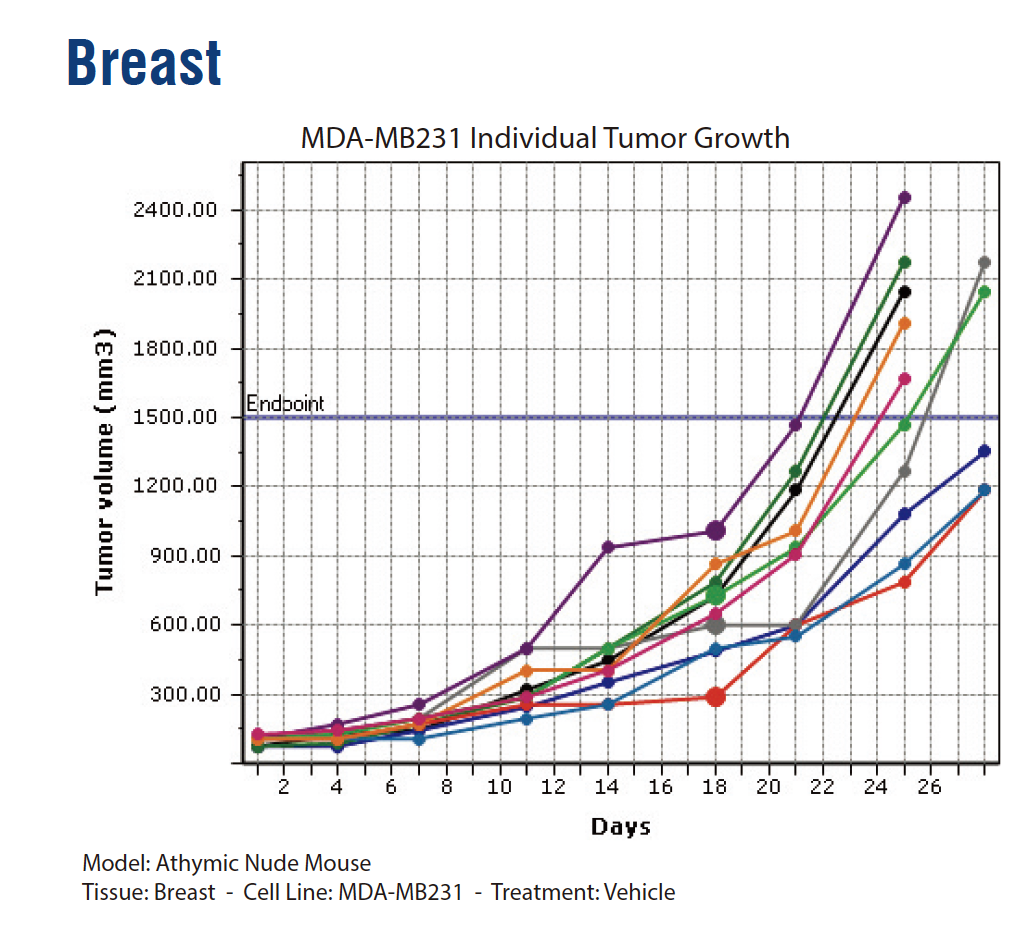
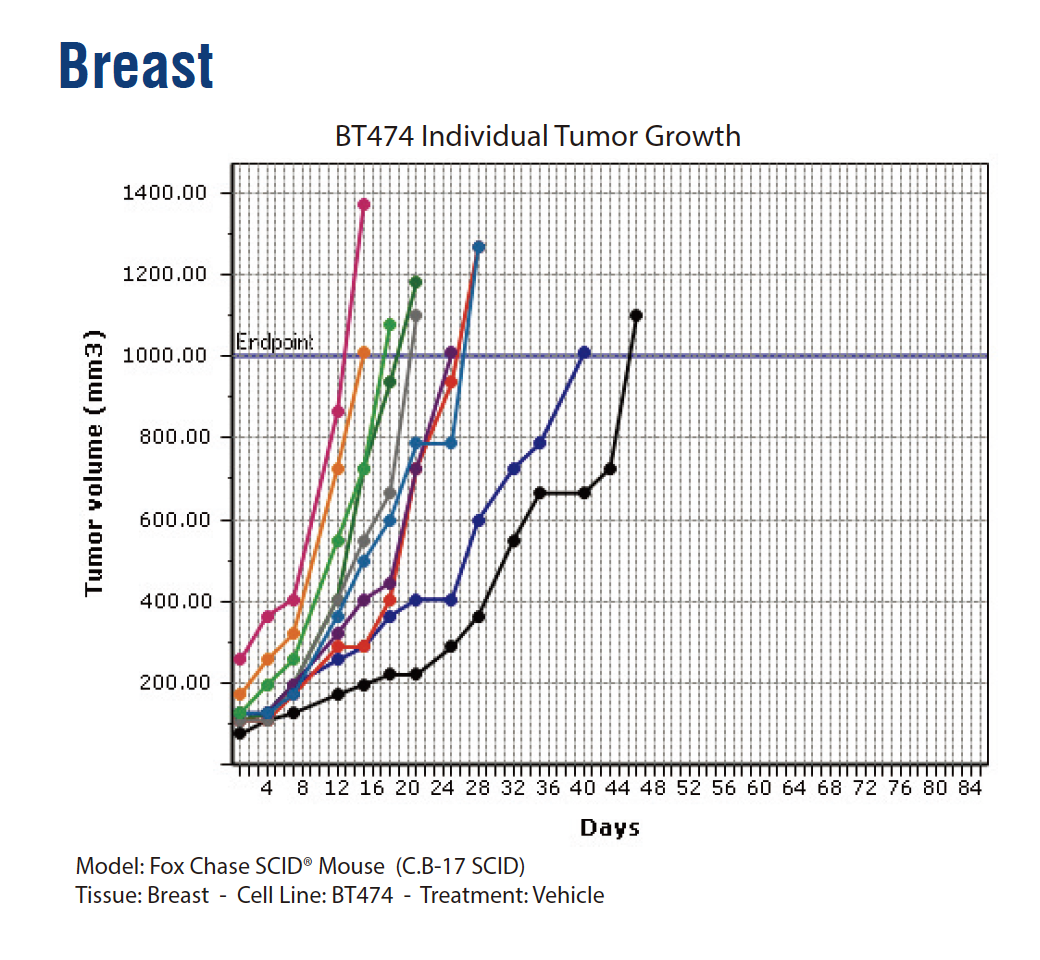
所谓“模糊对应”关系,意思是“借助前人文献和经验建立的联系,但尚无系统的统计学证据”。但广泛的文献参考和经验性规律,足以帮助研究者初步判断如何缩小实验条件的“搜索范围”,快速定位到一种或者几种满足造模需求的品系,降低试错的时间和资金成本。本着这个目的,我们对来自人体的二十多种器官或组织的77种肿瘤细胞系,使用不同程度免疫缺陷鼠造模,以获得肿瘤生长曲线图,这部分的材料参考可以在文末获得。
值得一提的是,CAR-T作为一种特殊的细胞类药物,建立临床前肿瘤模型时,需要提前考量更多的因素,如体内研究中动物模型对CAR-T药物的排斥反应。我们在与客户合作的研究项目中发现血液瘤CAR-T研究使用超重度免疫缺陷小鼠优势更明显, 原因在于NOG小鼠对CAR-T药物的排斥较低,这对细胞治疗药物的临床前药效研究有非凡的意义。然而,研究者发现由于CAR-T等T细胞药物在NOG、NSG小鼠中会出现xeno-GvHD反应(移植物抗宿主病),使得小鼠状态差难以进行长时间的药效评估;另外,这也一定程度转移了部分真正用于抗肿瘤作用的T细胞药物。我们“第二代”NOG小鼠管线之一的NOG-dKO小鼠*,敲除了在xeno-GvHD反应发挥重要作用的分子,Tomonori Yaguchi et al.在研究中证实NOG-dKO小鼠可以更准确评估CAR-T药物的抗肿瘤活性。详细内容我们将在后续的文章中与读者分享。
NOG-dKO小鼠*:指在NOG小鼠基础上敲除B2m 和Ab1 基因,使小鼠 MHC I/II 分子缺失的动物模型。
临床前试验成功的候选药物,最终只有少于10%的比例获准进入市场,对抗肿瘤药物而言,这一数字更低,约为5%。临床转化率如此低的一个重要原因是缺乏适当的人类癌症模型,常用的小鼠自发性肿瘤模型和人类细胞系移植的肿瘤模型并不能体现人类原始肿瘤特性。而PDX模型是将肿瘤组织以组织的形式移植至免疫缺陷鼠体内,并没有经过任何人工培养,所以较完整地保留了肿瘤的生物学特性, 保持了肿瘤的异质性 ,因而与临床相似度更高,是现阶段最可靠的肿瘤动物模型。
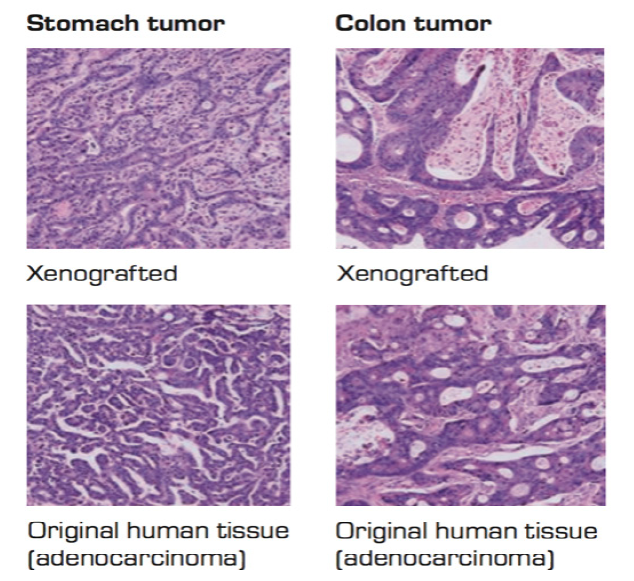
制备PDX模型时,除了要评估移植成功率,更重要的一点是要保持原始肿瘤的生物学特性,这使得PDX建模难度较高。而超重度免疫缺陷鼠(NOG、NSG)的引入,逐渐解决了以上困境:对肿瘤的选择压力小,为原发肿瘤的移植提供了最佳环境。例如Fujii E et al. 在Pathology International发表的文献中,利用NOG小鼠建立的Stomach Tumor和Colon Tumor PDX模型的病理形态与原始肿瘤样本相似。
有些特殊的肿瘤样本比常见的更难成瘤,例如急性髓系白血病(AML)建PDX模型可能会遇到较大的挑战——因为髓系细胞的分裂和增殖需要有人源细胞因子的参与。CHAMPIONS ONCLOGY的研究结果表明,NOG二代品系NOG-EXL小鼠*在制备AML PDX移植时,相较于NOG,成功率由42%提高到100%。详细内容我们将在后续文章中与您分享。
NOG-EXL小鼠*:指在NOG基础上转入人的细胞因子IL-3和GM-CSF
这取决于您的研究是否需要人免疫系统的参与。很多研究中的肿瘤药物(如化疗药、小分子抗肿瘤药物、肿瘤抗体靶向药等)作用靶点在于肿瘤细胞,将人源肿瘤细胞移植到免疫缺陷小鼠体内,建立的CDX/PDX肿瘤异种移植模型即可满足药物筛选需求。
但如果是目前火热的肿瘤免疫疗法,例如PD-1/PD-L1免疫检查点抑制剂、双特异性抗体等,其药物靶点在于人的免疫系统,要想实现 “人免疫系统与人源肿瘤”的相互作用,就需要在小鼠体内建立“模拟的”人免疫系统。药物研发人员确定所研药物的靶点在某种特定免疫细胞后,下一步需要寻找对应的免疫系统重建模型,此时通常需要动物模型专家与研发人员的更深入的沟通来确定。一旦客户提出这方面的想法,我们会与客户一起仔细探索这4个问题:
1) 研究课题中应该构建何种类型的免疫系统重建小鼠?
2) 小鼠模型直接接受人源的T细胞后是否能提供足够的“窗口期”完成实验?
3) 能否想办法让重建模型体内生长和分化出所需免疫细胞?
4) 除了人体的T细胞,能否能够分化出更多的细胞类型,以满足测试不同作用靶点的药物?
相信这些不光是我们在研发小鼠模型的阶段每天锁紧眉头考虑的问题,也是我们的客户在为了实验项目的成功、节约时间和成本不得不去思考的问题。在今后我们的研发过程中,也非常乐意与您讨论和共同建立下一代人源化模型。我们也将在下一期重点讨论当前研发热点中“免疫系统人源化”面临的挑战。
要获得稳定性高、可重复性好的实验结果,实验动物本身的技术属性只是一个重要方面,还有几个容易被忽视的关键因素需要考虑:
1)备选细胞系/肿瘤组织是否经过微生物检测,排除其携带影响实验可重复性的病原体?
2)备选品系是否来自于生物安全管理严格的设施,确保其不携带影响实验结果判定的病原体?
3)备选品系是否有严格的遗传管理程序,保障其表型没有受到“遗传漂变”的影响?
如果研究使用经过传代操作的细胞系建立CDX模型,要考虑传代过程中发生污染的可能性,推荐对其进行微生物检测,有很多病原体(例如牛棒状杆菌)感染动物后不仅造成体重异常,影响实验结果判断,还会扩散到设施更多的动物放大负面影响。其次,来源设施的生物安全管理体系和遗传管理程序如何——这些细节也许是与采购和实验设施管理人员更关注的问题;那么对于研究人员,除了通过引种证明、遗传学鉴定、表型鉴定等技术指标可以作为判别“遗传管理”的参照,可能要考虑计划采购动物模型的供应商的历史、积淀等“软性因素”,最大程度降低这些技术品质以外的因素对实验可重复性的影响。
综上,建立肿瘤研究模型前,有4个“大面”上的因素不能忽视:
1. 根据肿瘤种类选择合适的免疫缺陷动物
2. PDX模型如何保持与原始肿瘤相似的生物学特性
3. 是否需要对动物模型进行人源化免疫系统改造
4. 动物模型属性外因素:生物制品污染、微生物状况、遗传管理
1.DewanMZ,WatanabeM,AhmedS,TerashimaK,HoriuchiS,SataT,HondaM,ItoM,WatanabeT,HorieR,YamamotoN.(2005)Hodgkin’slymphomacellsare effciently engrafted and tumor marker CD30 is expressed with constitutive nuclear factor- B activity in unconditioned NOD/SCID/gammacnull Cancer Sci., 96(8):466- 473.
2.NinomiyaM,AbeA,KatsumiA,XuJ,ItoM,AraiF,SudaT,ItoM,KiyoiH,KinoshitaT,NaoeT.(2007)Homing,proliferationandsurvival sites of human leukemia cells in vivo in immunodeficient mice. Leukemia, 21:136-142.
3.Yaguchi T,Kobayashi A,Inozume T , et al. Human PBMC-transferred murine MHC classI/II-deficient NOG mice enable long-term evaluation of human immune responses[J]. Cellular & Molecular Immunology,2017.