近年来肿瘤免疫治疗在临床上的应用取得了突破性进展,打破肿瘤微环境免疫抑制机制将是肿瘤免疫研究下一步的研究方向。寻找更完善的免疫系统人源化模型,在进行抗肿瘤药物治疗时,能够利用人的免疫系统与肿瘤相互作用,成为了研究者争相追逐的热点。
在以初代NOG/NSG小鼠为背景的免疫系统重建模型中无法有效重建髓系细胞,科学家一直在探索更优化的体内模型解决这一问题,国际上曾报道过NOG-EXL, NSG™-SGM3 以及 MISTRG三种细胞因子转基因模型均可成功移植huHSC,且重建人髓系细胞水平高于对照组的基础免疫缺陷模型。那么这三种模型在肿瘤免疫治疗的实际应用如何呢?
科学家Maser I-P对人源化NOG-EXL和NSG-SGM3的最新研究表明,NOG-EXL小鼠经过人源化后能模拟人类免疫细胞的组成,且能保证存活率。今天我们将深入解读NOG-EXL小鼠为何能够脱颖而出并将如何助力于您的肿瘤药物研发?
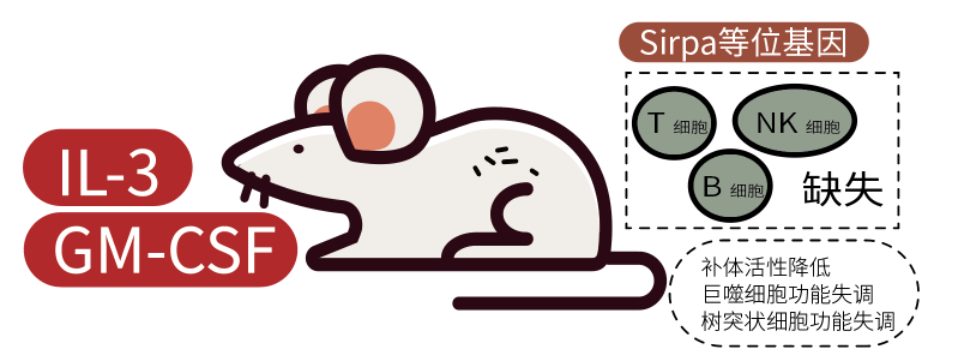
我们今天的主角NOG-EXL小鼠是新一代NOG小鼠衍生品系,是在NOG小鼠基础上引入编码人类IL-3和GM-CSF的转基因小鼠, 与基础NOG/NSG小鼠相比,huHSC移植后,人源的单核细胞、树突状细胞和其他重要的细胞类型均有大幅增加, 呈现了更完整的人类免疫系统。
NOG小鼠具备超重度免疫缺陷特性(T、B、NK细胞缺失),补体活性降低,巨噬细胞和树突状细胞功能失调,携带NOD背景中特异性Sirpa等位基因,这些特性使其成为人的免疫系统移植的优质宿主。
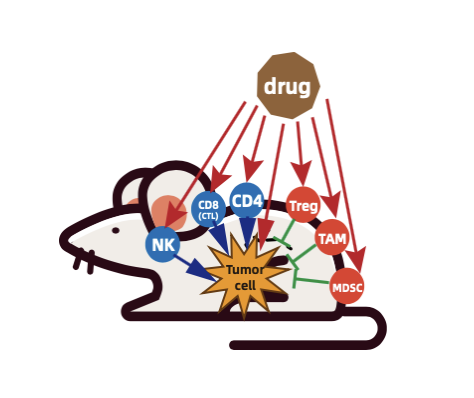
随着PD-1, PD-L1/CTLA4抗体在多种肿瘤类型的部分患者中表现出较为持久的抗肿瘤效应,免疫检查点抑制剂(ICIs)已经显著改变了癌症的治疗方法。然而,这些抗体并不是普遍有效的,临床上大约80%患者对ICIs治疗没有应答,这表明它们可能无法有效刺激抗肿瘤免疫系统。
研发人员更多地意识到先天性免疫系统及肿瘤微环境在肿瘤的发生发展中发挥了重要的作用,也将研发重点转移至先天免疫系统来辅助进行肿瘤的免疫治疗,如髓系细胞MDSCs(骨髓来源的抑制细胞) 和TAMs(肿瘤相关巨噬细胞),NK细胞和DC细胞等,并取得了显著的效果。
将人的HSC移植到NOG小鼠中的最大挑战在于:HSC在分化的过程中,髓系细胞前体需要特定的细胞因子信号进行进一步的分化。然而,一些内源性的鼠源细胞因子不能充分地与人源的细胞因子受体相互作用,导致髓系细胞分化率非常低,因此在小鼠体内成熟的髓系细胞数量非常少。
通过不同方式补充人的细胞因子,均可实现髓系细胞的重建。可以通过给小鼠注射外源的人类细胞因子,也可以通过不同的基因转染方式实现这一目标。但日本CIEM的Mamoru Ito(CIEM NOG小鼠的创始人)的研究表明,引入编码人类IL-3和GM-CSF的转基因NOG小鼠,将会是更简单有效的一种方式。简单来说,CD34+移植后的huNOG-EXL小鼠体内呈现更完整的人类免疫系统,包括成熟的粒细胞,单核细胞,巨噬细胞,B细胞和T细胞。
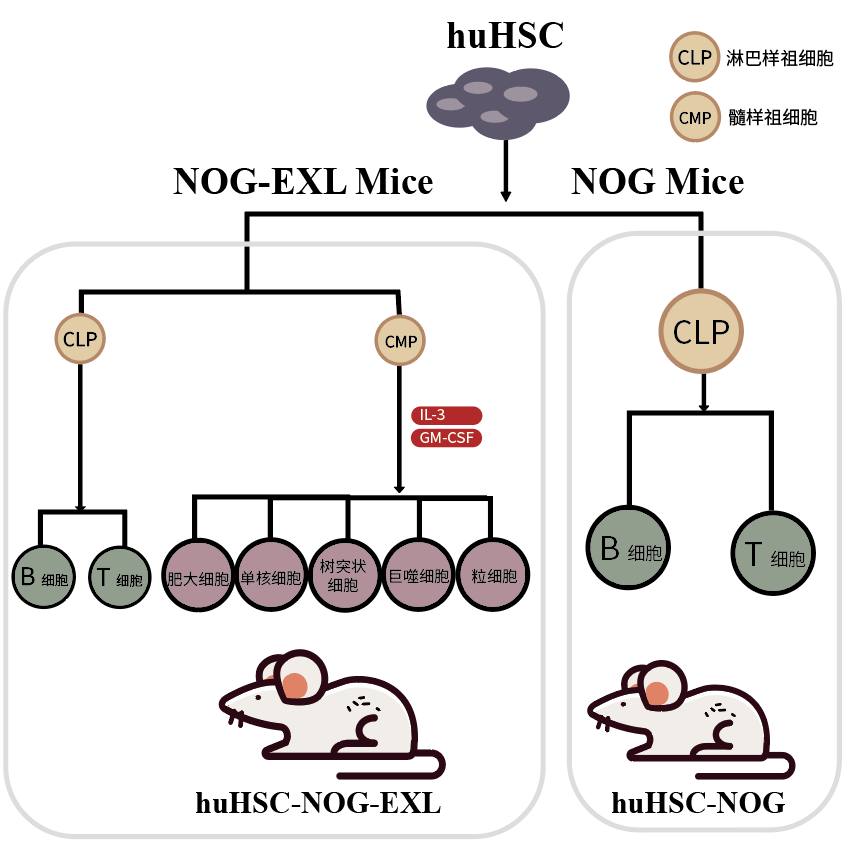
huHSC-NOG-EXL人源化小鼠中髓系细胞表达上升,呈现了更完整的人的免疫系统,为肿瘤免疫治疗的临床前研究提供了较好的体内研究平台,极大地促进及改善了肿瘤免疫疗法的研发进程。
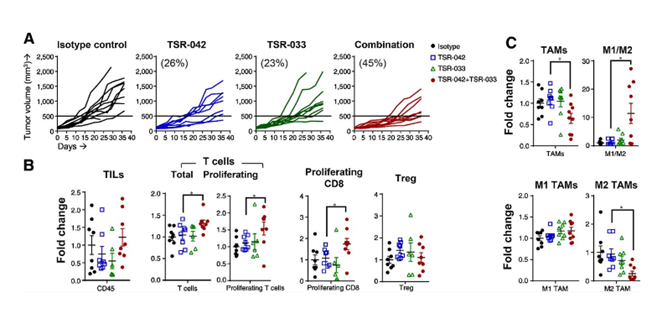
生物制药公司Tesaro的研究者利用huNOG-EXL小鼠制备的NSCLC(A549细胞系移植)肿瘤模型进行联合治疗(两种LAG-3抗体)的抗肿瘤研究,结果展示了联合疗法显著增强了抗肿瘤效应。进一步对肿瘤内部免疫细胞的流式结果表明,与对照组相比,治疗组小鼠肿瘤内浸润淋巴细胞(TIL)增加。同时,PD-1和LAG-3抗体的联合给药也降低肿瘤相关巨噬细胞(TAM)的总体频率,特别是免疫抑制型M2巨噬细胞的含量。²
Champions Oncology的研究也发现 huNOG-EXL小鼠进行PDX移植后,在肿瘤内部有淋巴细胞和髓系细胞的浸润:CD3+细胞、MDSCs和T细胞亚群等等,可用于免疫肿瘤治疗中新的靶点药物的评估。³
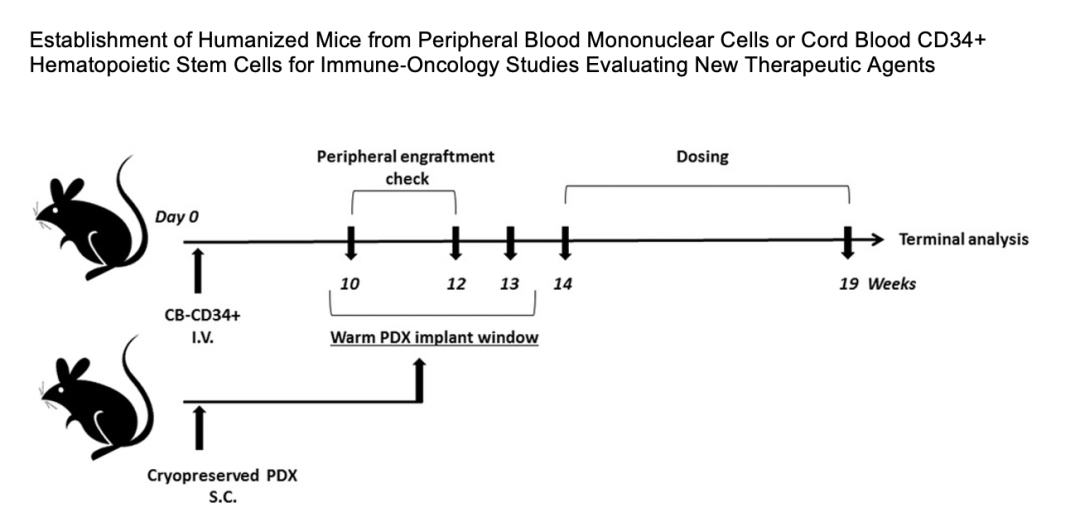
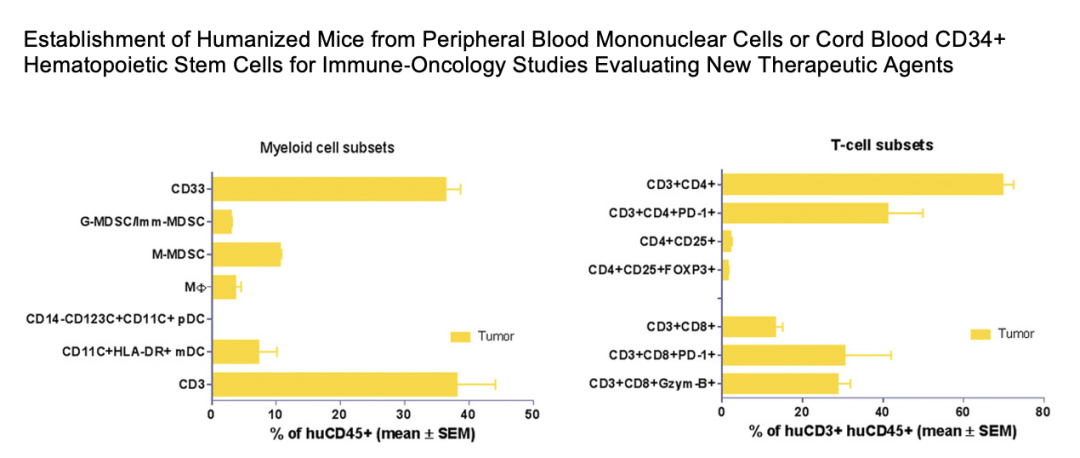
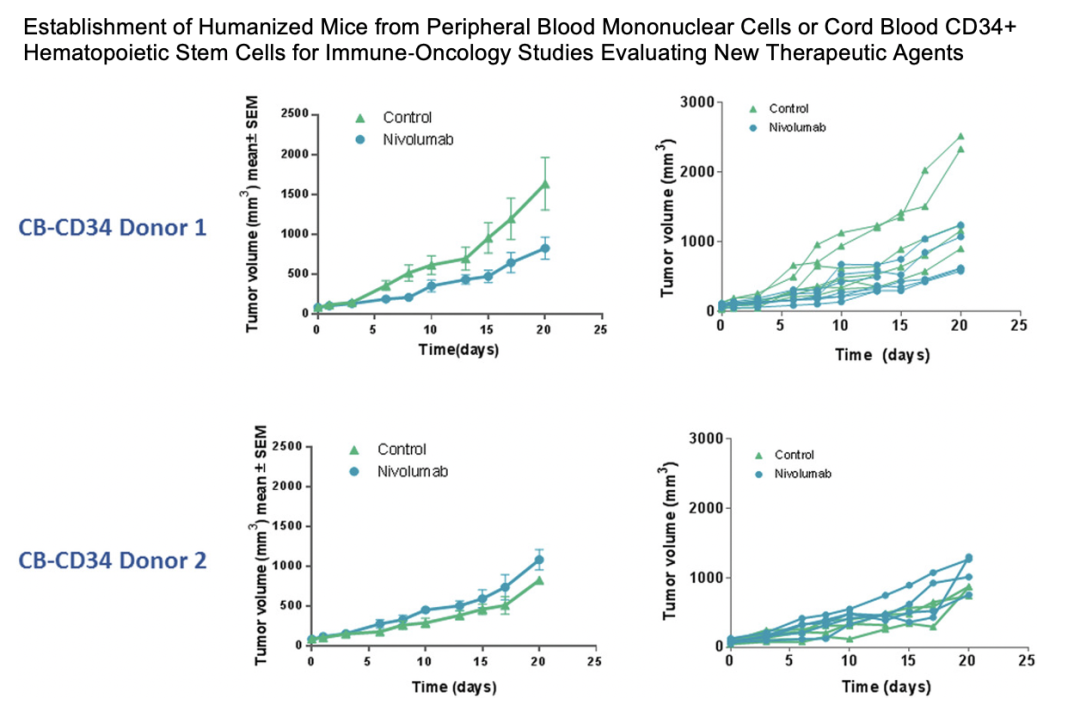
在另一项研究中由Tesaro和Charles River将三种不同类型的肿瘤植入huNOG-EXL小鼠体内,并在这些肿瘤中鉴定出不同的人类淋巴和髓系细胞。 这些研究表明huNOG-EXL小鼠能够成功植入关键的人类免疫细胞类型,并为肿瘤生长和治疗提供充足的时间窗口支持IO研究。
制备任何人源化免疫系统模型时都可能受到供体细胞固有特性的影响,单个供体批次内移植时的失败率(定义为人源化后嵌合率小于25%的现象)也因供体而异。
与第一代NOG/NSG等超重度免疫缺陷小鼠相比,CD34+人源化NOG-EXL小鼠的批次内失败率(定义为人源化后嵌合率小于25%的现象)要低很多。Champions Oncology的数据展示,当NOG-EXL小鼠被植入四个单供体的干细胞时,观察到接近零的失败率。而NOG小鼠由于没有人类细胞因子辅助,在所有批次的供体中都会有部分的失败情况发生。
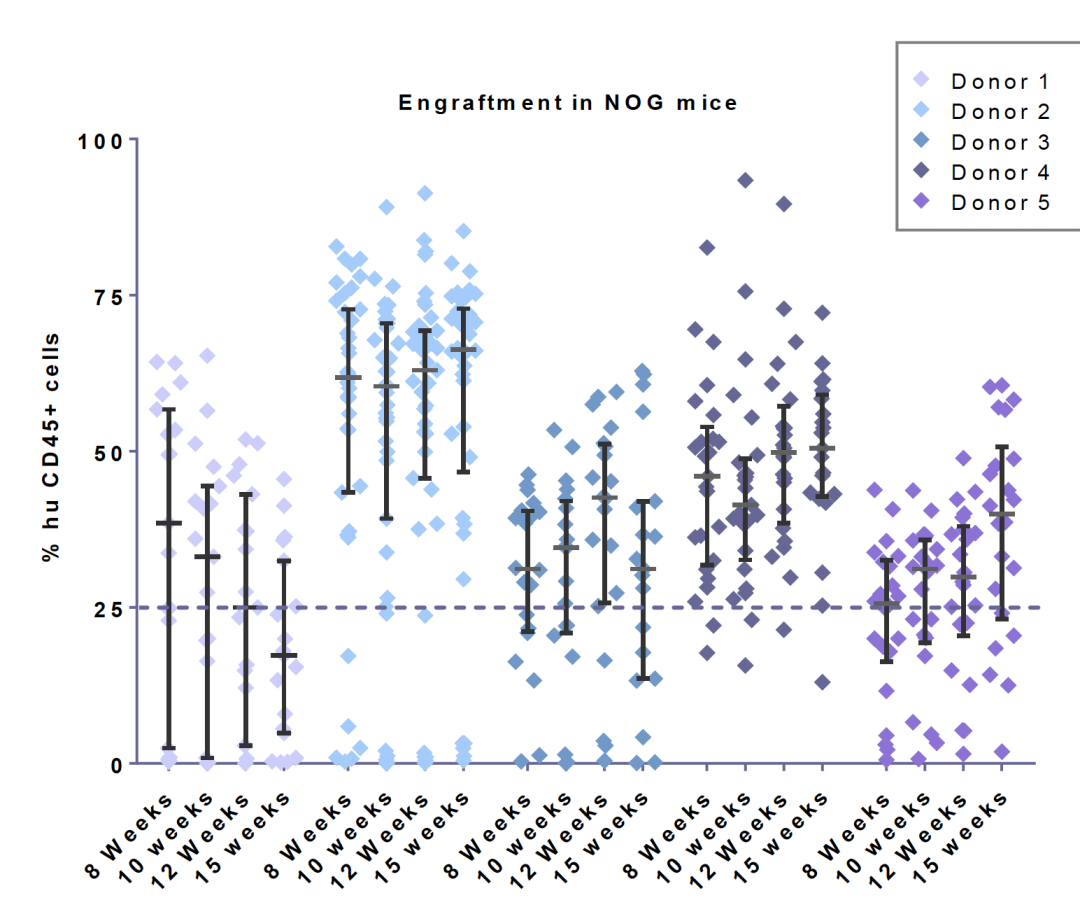
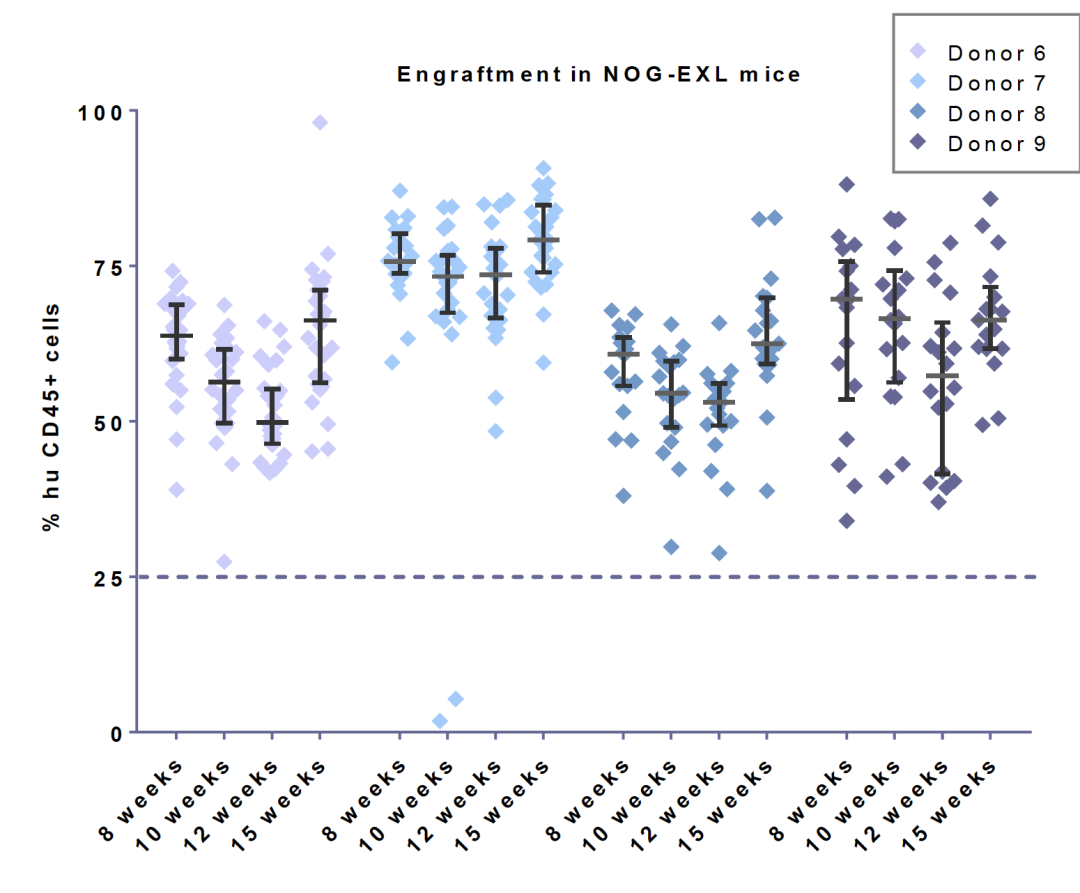
NOG-EXL比NOG小鼠采用单供体人脐血源CD34+HSC的植入成功率高。
包括NOG-EXL小鼠在内,目前科学家已探索了几种通过转入人细胞因子基因增强髓系细胞分化的动物模型,比如NSG-SGM3、MISTRG。这几种看起来设计原理类似的模型,应用于研发试验中,究竟有何不同之处呢?我们总结了文献报道的一些内容,可供大家参考。
NSG™-SGM3
这个NSG™-SGM3,也称为NSGS,在NSG上表达三种不同的人类细胞因子GM-CSF、IL-3和KITLG 。该转基因模型使用了相对较强的病毒CMV启动子,并导致细胞因子的表达水平为超生理水平。
MISTRG
MISTRG基本模型是在BALB/c x 1292S4混合背景上的Rag2/Il2rg双敲除。由于该背景(与NOD不同)不适合人类干细胞的植入,因此添加了一个表达人SIRPα的转基因来改善造血干细胞(HSC)的植入。此外,该模型还表达人GM-CSF、IL-3、M-CSF和TPO。除hGM-CSF外,这些细胞因子均位于内源性小鼠启动子下。
MISTRG由耶鲁大学Richard Flavell设计,并与Regeneron Pharmaceuticals合作制造。杰克逊实验室曾在2015年引进该品系,然而随后就停止了MISTRG的生产。
研究者Maser I-P通过对人源化NOG-EXL和NSG-SGM3的最新研究表明,NOG-EXL小鼠经过人源化后最能模拟人类免疫细胞的组成,并提高了存活率。
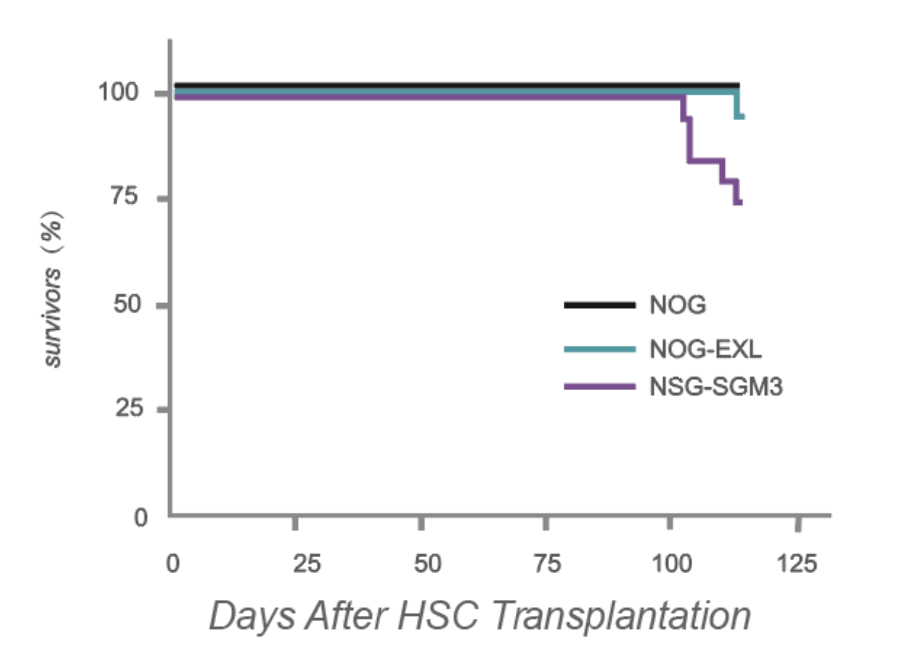
与人源化NSG-SGM3相比,人源化NOG-EXL小鼠的存活率明显升高,源自Maser I-P等的研究结果。
文献报道NSG-SGM3在huHSC移植后,100%的小鼠在移植后10至27周内死亡⁴,而所有未植入的对照组小鼠都正常存活,进一步研究发现原因为NSG-SGM3小鼠过量表达人细胞因子IL-3、GM-CSF和SF(2000-4000pg/mL),导致造血干细胞分化加速,过早衰竭,进而发生严重的致死性贫血,很大程度上限制了其在肿瘤免疫研究中的应用。
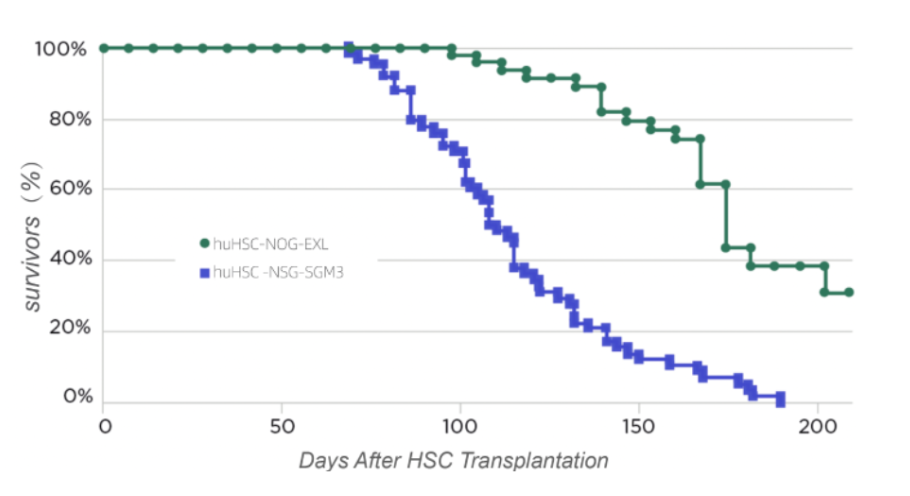 NSG-SGM3移植数据来源文献:A xenograft model of macrophage activation syndrome amenable to anti-CD33 and anti-IL-6R treatment。
NSG-SGM3移植数据来源文献:A xenograft model of macrophage activation syndrome amenable to anti-CD33 and anti-IL-6R treatment。
移植后16周,大约50%的人源化NSG-SGM3小鼠会死于贫血,而huHSC-NOG-EXL存活率仍高于90%。此外,在移植后30周,人源化NSG-SGM3小鼠全部死于贫血后,huNOG-EXL存活率仍超过30%。
相比之下,虽然huHSC-NOG-EXL小鼠随着时间的推移也会出现轻微贫血现象,但绝大多数不会发展为严重的贫血,存活时间远远超过了人源化NSG-SGM3。究其原因为NOG-EXL小鼠表达人细胞因子更接近生理水平(GM-CSF和IL-3细胞因子水平分别为~35pg/mL和~80pg/mL)。⁵
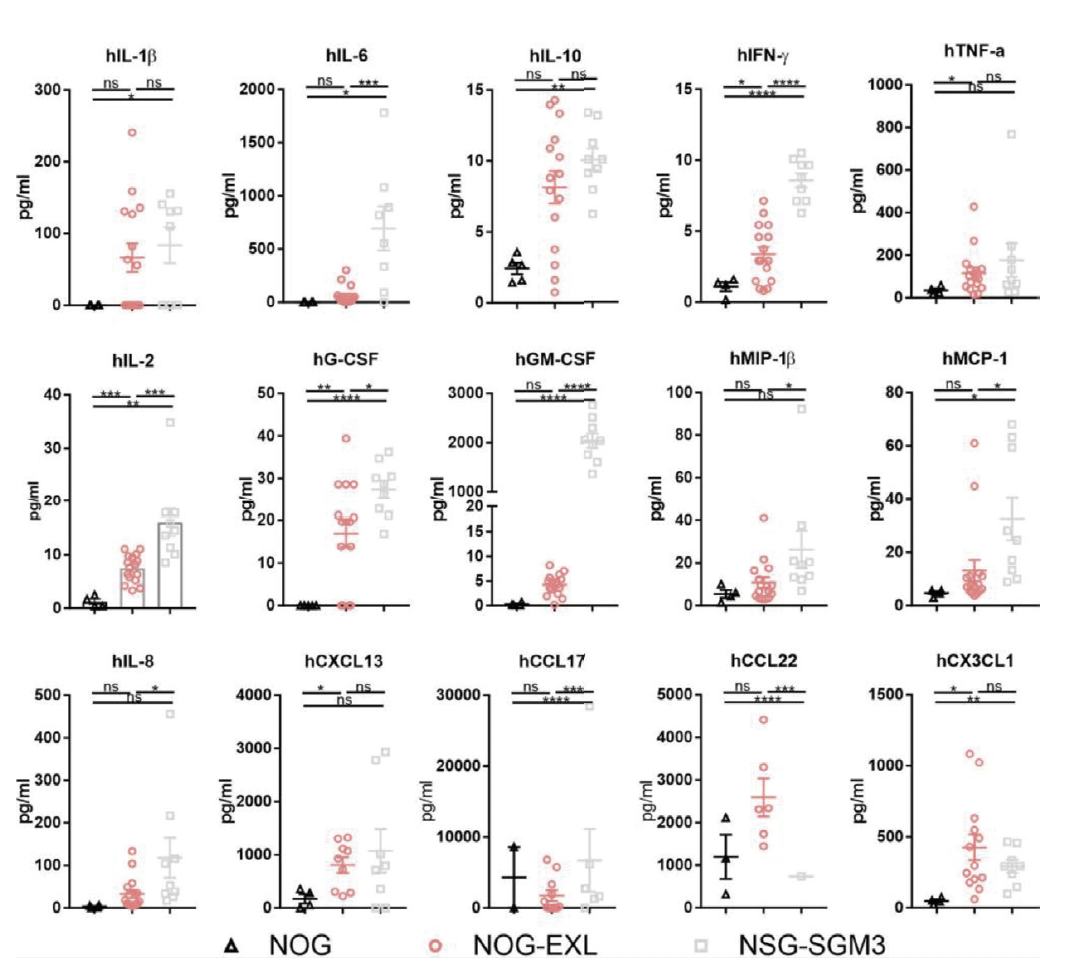 用Bio-Plex分析人源化小鼠血清中的人细胞因子和趋化因子。源自Maser I-P等的研究结果。
用Bio-Plex分析人源化小鼠血清中的人细胞因子和趋化因子。源自Maser I-P等的研究结果。
huHSC人源化后,与NOG小鼠相比,NOG-EXL和NSG-SGM3均显示出人类细胞因子谱显著增加。与人源化NSG-SGM3中的促炎因子相比,人源化NOG-EXL小鼠具有更生理、低炎症的细胞因子谱。
涉及到髓系细胞及肿瘤微环境的药物研发时,huHSC-NOG-EXL小鼠是优选的人源化模型。
1、huHSC-NOG-EXL中人源的单核细胞、树突状细胞和其他重要的细胞类型均有大幅增加,人源免疫系统重建失败的风险降低。
2、与市场上现有模型相比(NSG-SGM3), 人源化NOG- EXL小鼠重建了一个更接近于人的免疫系统。NOG-EXL小鼠经过人源化后能模拟人类免疫细胞的组成,并提高了存活率。
3、 维通利华NOG-EXL每只小鼠都经过基因型鉴定。
4、维通利华提供现成的huHSC-NOG-EXL模型(已验证的外周血人源免疫细胞重建率「hCD45≥25%」),以避免科研工作者3-4个月的等待时间。
如果您想了解你感兴趣的免疫细胞是否在人源化模型中重建并发挥作用,可与我们的技术人员进行科学咨询,讨论并选择最适合您研究的人源化模型。我们可以帮助规划您的研究,选择对您最合适的技术且最有价值的模型。
huHSC-NOG(现货)
huPBMC-NOG(订单生产,一周发货)
huHSC-NOG-EXL(现货)
huPBMC-NOG-dKO(订单生产,一周发货)
参考文献
1.Wang Z, Sun K, Xiao Y, et al. Niraparib activates interferon signaling and potentiates anti-PD-1 antibody efficacy in tumor models. Sci Rep. 2019;9(1):1853.
2.Ghosh S, Sharma G, Travers J, et al. TSR-033, a Novel Therapeutic Antibody Targeting LAG-3, Enhances T-Cell Function and the Activity of PD-1 Blockade and . Mol Cancer Ther.2019;18(3):632-641.
3.Verma B , Wesa A . Establishment of Humanized Mice from Peripheral Blood Mononuclear Cells or Cord Blood CD34+ Hematopoietic Stem Cells for Immune‐Oncology Studies Evaluating New Therapeutic Agents[J]. Current protocols in pharmacology, 2020, 89.
4.Maser I P , Hoves S , Bayer C , et al. The Tumor Milieu Promotes Functional Human Tumor-Resident Plasmacytoid Dendritic Cells in Humanized Mouse Models[J]. Frontiers in Immunology, 2020, 11:2082.
5.Wunderlich M , Stockman C , Devarajan M , et al. A xenograft model of macrophage activation syndrome amenable to anti-CD33 and anti–IL-6R treatment[J]. JCI Insight, 2016, 1(15).